
Победа над генетическими заболеваниями — давняя мечта человечества. Такие болезни считались неизлечимыми, и во многих случаях означали раннюю смерть пациента. К счастью, времена меняются. Близится эра генной терапии: первые препараты-пионеры уже продаются на рынке, еще сотни проходят клинические испытания. Но какую роль в этом сыграл аденоассоциированный вирус? Как его превратили в самое дорогое лекарство на планете, и почему выбор пал именно на него? Какие трудности предстоит решить, чтобы сделать генную терапию общедоступной? Постараемся ответить на эти вопросы в данной статье.
Введение
Эта история началась в середине 1960-х, когда в препаратах аденовируса обезьян случайно было обнаружено загрязнение из маленьких неизвестных частиц. Эти частицы были впоследствии названы аденоассоциированным вирусом (сокращенно ААВ, англ. adeno-associated virus, AAV). Тогда мало кто мог предположить, что именно эти крошечные вирусы дадут надежду многим неизлечимым больным. И лишь несколько исследовательских групп, движимых чисто научным любопытством, отправились изучать базовую биологию ААВ.
Прошло несколько десятков лет, и стало понятно, что ААВ обладает множеством уникальных свойств. Эти особенности позволяют использовать его в поистине революционном направлении — генной терапии. По разным оценкам, около 5% новорожденных детей страдает от различных генетических заболеваний. Долгие годы такие болезни считались неизлечимыми, и для многих подобный диагноз приравнивался к приговору. К счастью, времена изменились. Мы находимся на пороге эры лекарств принципиально нового типа, и немаловажную роль в этом сыграл аденоассоциированный вирус.
Биология вируса
Какими же уникальными особенностями обладает ААВ? Чтобы ответить на этот вопрос, нужно подробнее поговорить про его жизненный цикл и строение.
Аденоассоциированный вирус принадлежит к роду Dependoparvovirus семейства Parvoviridae. Название рода отражает его необычный жизненный цикл, когда для размножения необходимо наличие вспомогательного вируса (от лат. Dependo — «зависеть»). В качестве такого вируса-помощника, как правило, выступает аденовирус (что явно следует из названия) или представители семейства герпесвирусов.
ААВ настолько безобиден, что помимо неспособности самостоятельно размножаться, он не вызывает никаких заболеваний человека и животных. Более того, согласно некоторым исследованиям, большинство людей (>70%) в течение жизни были заражены одним или несколькими серотипами ААВ. (Серотип — вариант вируса, который отличается от других антигенами на своей белковой оболочке).
Вирус довольно мал — его икосаэдрическая белковая оболочка (капсид) в диаметре составляет всего около 25 нм (риc. 1а). Капсид необычайно стабилен: устойчив к кратковременному воздействию тепла, кислой среде и протеазам. Геном, представленный одноцепочечной ДНК, по размерам также весьма скромен — всего 4,7 тысяч нуклеотидов.
Этот небольшой геном содержит минимальное количество генов. Ген rep (от слова replication) кодирует белки, необходимые для размножения вируса и его дальнейшей сборки внутри клетки (рис. 1б). Ген cap (от слова capsid) кодирует белки капсида (рис. 1б).
Геном ААВ обрамлен двумя Т-образными шпильками — инвертированными концевыми повторами (inverted terminal repeats, ITR) (рис. 1б).
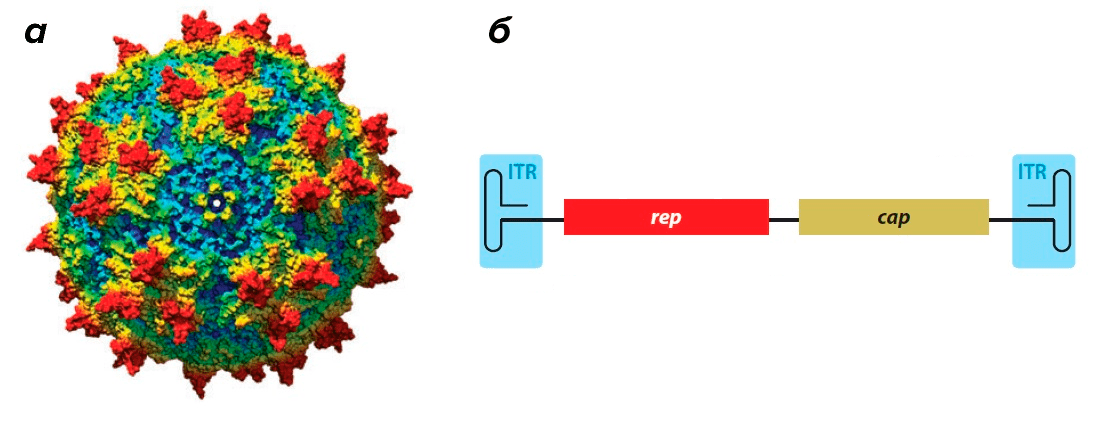
Рисунок 1. Аденоассоциированный вирус. а — Модель капсида ААВ. б — Геном аденоассоциированного вируса. ITR (inverted terminal repeats) — инвертированные концевые повторы, образующие Т-образные шпильки; rep — ген, кодирующий белки, отвечающие за репликацию; cap — ген, кодирующий белки капсида.
Судьба вируса в клетке
Ценное свойство ААВ — его способность проникать как в делящиеся, так и неделящиеся клетки. На первом этапе аденоассоциированный вирус связывается с рецептором на поверхности клетки (рис. 2). Разные серотипы ААВ предпочтительно связываются со своими рецепторами, характерными для определенных типов клеток.
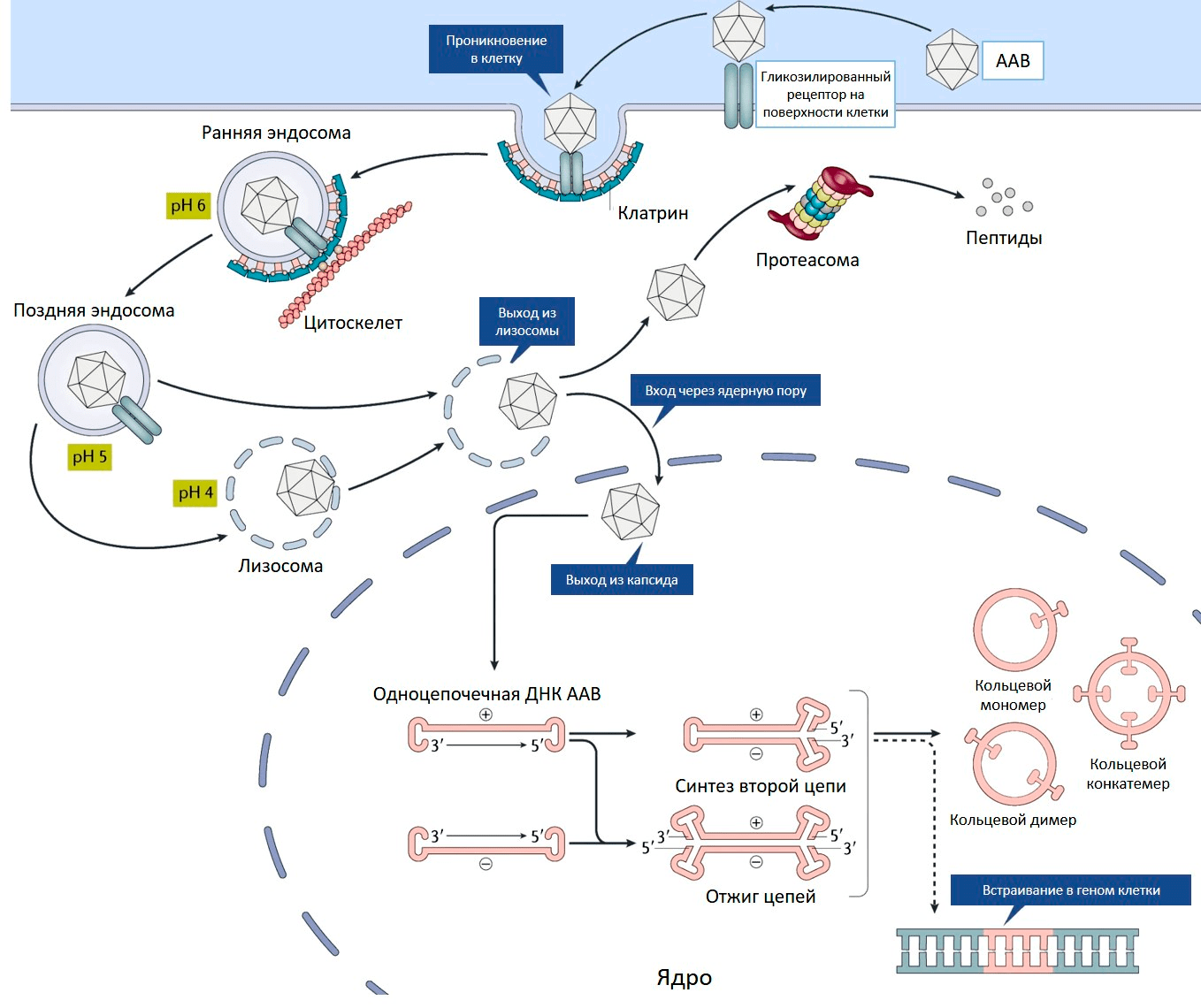
Рисунок 2. Проникновение ААВ внутрь клетки. Пояснения в тексте.
И это важное свойство — определенный серотип преимущественно проникает лишь в конкретную ткань или орган, то есть обладает своим уникальным тропизмом.
Связывание вируса с рецептором запускает процесс проникновения внутрь клетки. Эндосома (мембранный пузырек, содержащий вирусную частицу) передвигается в цитоплазме по цитоскелету. Постепенно среда в эндосоме закисляется, что приводит к изменениям капсида, необходимым для дальнейшего успешного заражения клетки. После выхода из эндосомы у вируса два пути. Либо он попадает в клеточную машину по уничтожению белков (протеасому) и разрушается, либо переносится в ядро, где вирусный геном высвобождается из капсида (рис. 2).
С одноцепочечного вирусного генома еще не могут нарабатываться белки, для этого необходимо достроить вторую цепь ДНК. Она синтезируется с помощью ДНК-полимеразы клетки-хозяина, используя шпильку ITR в качестве затравки для построения второй цепи.
Вирусные ITR помогают не только строить вторую цепь ДНК, но способствуют межмолекулярной и внутримолекулярной рекомбинации геномов вируса. В результате в ядре клетки образуются кольцевые молекулы ДНК — эписомы (рис. 2). В такой форме геномы ААВ могут в течение многих лет присутствовать в ядре.
Кроме того, геном ААВ может с низкой частотой встраиваться в определенный локус на 19 хромосоме человека. Этот феномен обусловлен сходством последовательностей ДНК данного локуса и ITR вируса. У ААВ, лишенного гена rep, способность к встраиванию своего генома сильно снижена. Такие вирусные геномы присутствуют в клетках в виде эписом.
Модификация ААВ для применения в генной терапии
Если в гене человека произошла мутация, которая привела к развитию заболевания, то болезнь можно победить или облегчить, если доставить в клетки организма рабочую копию поломанного гена. Вот тут и выходит на сцену аденоассоциированный вирус.
Что же нужно было в нем изменить, чтобы он стал курьером для доставки таких терапевтических генов? Как это часто бывает в биологии, ученые просто воспользовались успешными решениями, уже созданными природой. Раз капсид ААВ сам по себе является ключом к входу в клетку и ядро, то можно смело этим воспользоваться. Остается только заменить гены самого вируса на гены, интересующие исследователя, и вирусный курьер готов!
Модификация генома ААВ
Оказалось, что от всего генома ААВ необходимо было оставить только концевые шпильки ITR, необходимые для сборки самого вируса и сохранения его генома в ядре (рис. 3). Таким образом, можно без последствий удалить до 96% генома ААВ, используя полученное пространство для кодирования нужных генов.
Так как ААВ вмещает в себя всего около 5000 пар нуклеотидов, то нужно очень тщательно продумать остальной состав кассеты. В первую очередь туда необходимо поместить рабочую копию гена (трансген), в зависимости от того генетического заболевания, на которое направлено лечение. Также обязательно наличие регуляторных последовательностей, таких как промотор и сигнал полиаденилирования (рис. 3). Разберем элементы кассеты подробнее.
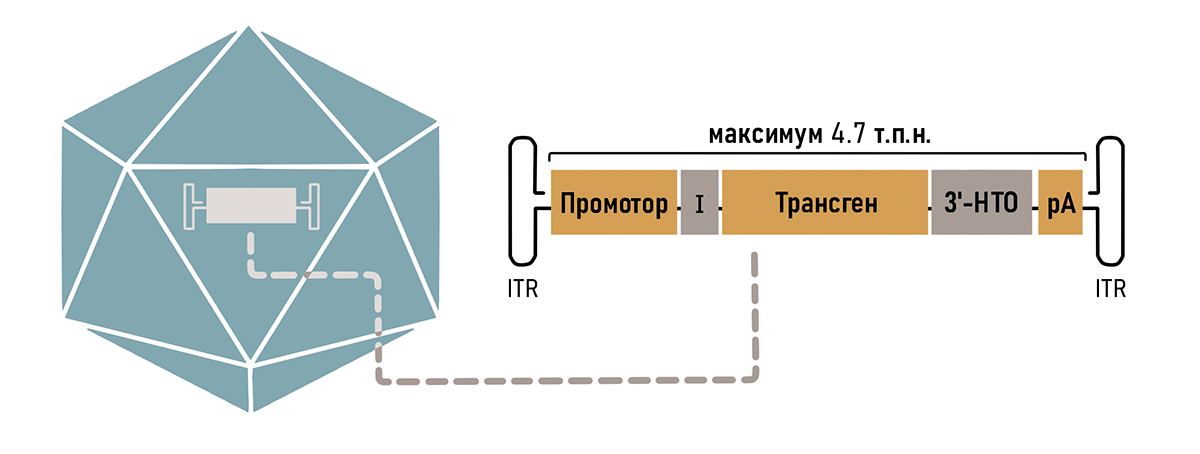
Рисунок 3. Компоненты типичной кассеты ААВ вектора. Оранжевые блоки (промотор, трансген и сигнал полиаденилирования — рА) являются обязательными компонентами. Для повышения эффективности экспрессии могут быть включены необязательные регуляторные элементы, такие как интрон (I) и другие компоненты 3′-нетранслируемой области (НТО). Кассета обрамлена инвертированными терминальными повторами (ITR).
Из-за ограниченной емкости вируса могут возникнуть трудности с доставкой больших терапевтических генов. Очевидное решение проблемы — разработка сокращенной версии гена, который кодирует усеченный, но функциональный белок. Создание таких укороченных генов требует глубокого понимания биологии терапевтического белка, взаимосвязи его структуры и функции. Такой подход уже успешно применяется в нескольких клинических испытаниях по лечению миодистрофии Дюшенна (ссылки на клинические испытания: NCT03368742, NCT04281485, NCT03769116), в доклинических исследованиях по лечению дисферлинопатии, амавроза Лебера и многих других заболеваний.
Другим потенциально перспективным подходом для доставки слишком больших трансгенов может быть разделение гена между двумя ААВ-векторами. Два этих векторных генома, попадая в одно и то же ядро клетки, могут подвергаться межмолекулярной рекомбинации с последующим восстановлением полноразмерного гена. Такой двухвекторный подход пока применяется лишь в редких клинических испытаниях (пример — NCT02710500). Низкая эффективность восстановления полноразмерного гена ограничивает более широкое применение этого приема.
Правильно выбранный промотор — во многом залог успешной генной терапии. Идеальный промотор должен запускать стабильную высокую экспрессию трансгена в пораженных органах в течение длительного периода, при этом быть неактивным в других тканях. Малая емкость ААВ также требует уменьшения размера промотора.
К кассету можно добавить необязательные элементы, способные улучшить экспрессию трансгена (рис. 3). Так, например, присутствие интрона повышает стабильность РНК в ядре, а также способствует эффективному транспорту мРНК из ядра в цитоплазму.
К обеспечению тканеспецифичности можно подойти с другой стороны — не только стимулируя экспрессию в целевых тканях, но и подавляя ее в нежелательных органах с помощью механизмов РНК-интерференции. Для этого в 3′-НТО-кассеты добавляют сайты связывания микроРНК, присутствующих строго в нецелевых органах (рис. 3). Если трансген оказывается в нежелательном органе, то микроРНК связывается с комплементарными ей сайтами в транскрипте и запускает его деградацию.
Модификация капсида ААВ
Хотя капсид ААВ — сам по себе уже удачное изобретение природы, человечество не остановилось в своем научном поиске. Новые серотипы ААВ могут обладать рядом преимуществ:
- они могут быть использованы у пациентов, у которых уже есть предсуществующий иммунитет к другим серотипам ААВ (см. ниже);
- новые серотипы могут отличаться другими тропизмами, что позволит направить терапию на ранее недоступные для лечения пострадавшие органы, либо более строго локализовать экспрессию трансгена в выбранном органе.
Благодаря развитию новых методов анализа выделяют несколько основных направлений для создания или выявления новых серотипов.
- Открытие серотипов, существующих в природе. Как уже упоминалось, большая часть человеческой популяции имеет антитела к ААВ. Таким образом, серотипы, распространенные среди людей, могут оказаться неудачным выбором для разработки препаратов. Решить данную проблему можно с использованием капсидов, выделенных из других животных, например, нечеловекообразных обезьян, крыс, мышей, свиней и других позвоночных.
- Рациональный дизайн. Этот подход предполагает модификацию капсидов уже существующих серотипов ААВ с целью добавления желаемых свойств. Так, можно направить тропизм ААВ на конкретные клетки, если в капсид будет встроен пептид, узнаваемый рецепторами этих клеток. Обдуманно внося изменения в белки капсида, можно сделать вирусные частицы более стабильными, уменьшить их тропизм к нецелевым тканям и даже снизить узнавание ААВ нейтрализующими антителами, тем самым обойдя предсуществующий иммунитет.
- Направленная эволюция. Стратегия рационального дизайна предполагает, что исследователь уже знает, к чему приведут внесенные изменения. Однако нельзя забывать, что наши представления о структуре и функционировании ААВ далеки от совершенства. Изменения капсидных белков могут привести к потере стабильности вирусной частицы и другим нежелательным последствиям. Альтернативный вариант — метод направленной эволюции, предполагающий создание вначале большого разнообразия капсидов (так называемых библиотек) и затем проведение многократных раундов отбора по определенному критерию. В итоге остаются только ААВ с требуемым свойством.
К сожалению, всегда существует вероятность, что хорошо работающий in vitro модифицированный капсид в экспериментах на лабораторных животных продемонстрирует низкую эффективность или даже токсичность. Всестороннее изучение свойств разрабатываемых препаратов и строгий контроль качества призваны минимизировать риск неблагоприятного исхода исследований.
Применение ААВ в клинике
Целевые органы, на которые направлена терапия
К 14 декабря 2020 года 227 препаратов на основе ААВ проходят клинические испытания (по данным сайта ClinicalTrials.gov). Сегодня уже существует несколько препаратов на основе ААВ, которые получили одобрение от регулирующих органов для коммерческого использования у пациентов:
- препарат Glybera; компания uniQure (ААВ1); для лечения дефицита липопротеинлипазы; выведен с рынка;
- препарат Luxturna; компания Spark Therapeutics/Roche (ААВ2); для лечения RPE65-ассоциированной ретинальной дистрофии;
- препарат Zolgensma; компания Novartis/AveXis (ААВ9); для лечения спинальной мышечной атрофии.
Большинство серотипов ААВ «предпочитают» проникать в такие органы, как печень, поперечно-полосатые мышцы и ЦНС, что и определило направление большинства программ генной терапии (рис. 4).
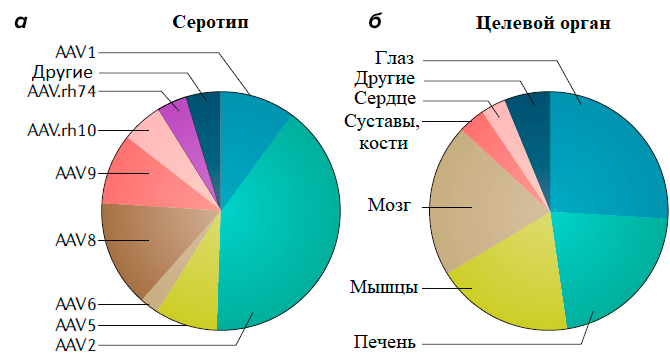
Рисунок 4. Данные с сайта ClinicalTrials.gov: на 13 ноября 2018 г. было зарегистрировано 145 клинических испытаний с использованием ААВ. а — Классифицикация клинических испытаний на основе примененного серотипа ААВ (AAV). б — Целевой орган, на который направлена терапия в указанных клинических испытаниях. Можно заметить, что спустя два года количество клинических испытаний с применением ААВ почти удвоилось (227 на сегодняшний день против 145 испытаний два года назад).
Почти все природные серотипы ААВ эффективно заражают печень после внутривенного введения. Благодаря данному свойству вируса в клинических испытаниях находятся препараты для лечения гемофилии A и B (NCT03392974, NCT03587116), семейной гиперхолестеринемии (NCT02651675), дефицита орнитинтранскарбамилазы (NCT02991144), мукополисахаридоза-IIIA (NCT03612869) и синдрома Криглера—Найяра (NCT03223194).
Серотипы ААВ8 и ААВ9 могут эффективно заражать разные типы мышц по всему телу. Такое свойство делает их идеальными векторами для генной терапии множества мышечных заболеваний. Так, активно исследуются в клинике препараты для лечения миодистрофии Дюшенна (NCT03375164), дисферлинопатии (NCT02710500), миотубулярной миопатии (NCT03199469), болезни Помпе (NCT03533673). Примечательно, что зараженная мышца может также служить биофабрикой для производства секретирующихся терапевтических белков для лечения немышечных заболеваний. Хотя большинство сердечных заболеваний полигенны и подвержены влиянию окружающей среды, ведется разработка препаратов генной терапии для лечения сердечной недостаточности.
Большой процент разрабатываемых препаратов на основе ААВ направлен на лечение неврологических и глазных болезней (рис. 4). Глаз — весьма обособленный орган, обладающий уникальной иммунологической толерантностью, и легко доступный для прямого введения препарата. Нетрудно понять, почему один из первых одобренных препаратов, «Люкстурна», был направлен именно на лечение наследственной слепоты. Мозг, напротив, намного более крупный и сложно организованный орган. Прямая доставка препарата в мозг или спинномозговую жидкость позволяет локализовать вирус и снизить дозу препарата, но это инвазивная процедура, сопряженная со многими рисками. К счастью, такие серотипы, как ААВ9 или ААВrh.10, могут пересекать гематоэнцефалический барьер, что позволяет использовать рутинное внутривенное введение. В настоящий момент в клинических испытаниях уже находятся препараты для лечения болезни Паркинсона (NCT02418598), метахроматической лейкодистрофии (NCT01801709), болезни Баттена (NCT01414985), мукополисахаридоза 3 типа (NCT03300453).
Основные стратегии генной терапии на основе рААВ
Можно выделить 4 глобальных направления генной терапии с применением ААВ (рис. 5).
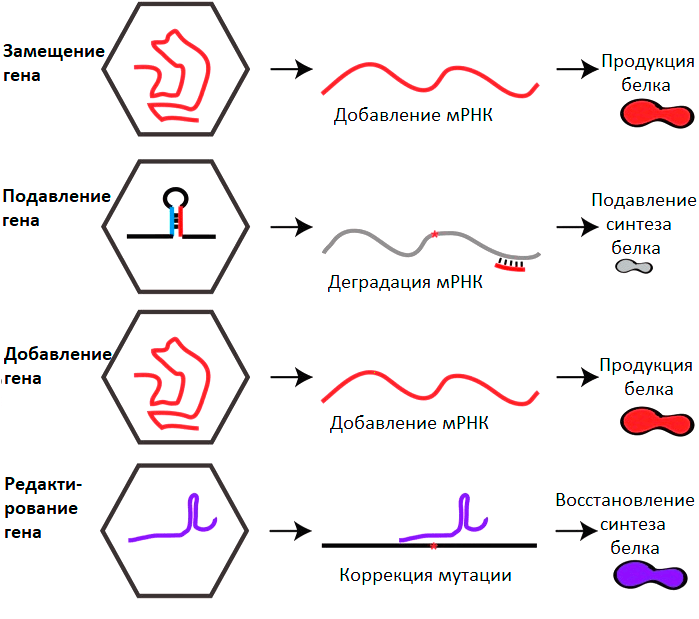
Рисунок 5. Основные стратегии генной терапии на основе ААВ. Пояснения в тексте.
- Замещение гена (gene replacement). Самая популярная стратегия, направленная на лечение моногенных заболеваний. Чтобы компенсировать эффект мутации, приводящей к образованию нефункционального белка или его отсутствию, пациентам доставляют работающую копию терапевтического гена. Все уже зарегистрированные препараты на основе ААВ успешно использовали именно этот подход. Во многих случаях восстановление синтеза белка даже на несколько процентов от нормального физиологического уровня может существенно облегчить болезнь. Кроме того, нет нужды доставлять трансген в каждую клетку пораженного органа. Для лечения многих заболеваний даже небольшой популяции зараженных клеток бывает достаточно. В настоящий момент на завершающей стадии клинических испытаний находятся препараты для лечения гемофилии А и В, хороидеремии, амавроза Лебера. В ближайшие пару лет можно ожидать их громкий выход на рынок.
- Подавление генов (gene silencing). Заболевания могут быть вызваны не только дефицитом необходимого белка, но и присутствием токсичного белка, который возник в результате мутации. Чтобы подавить его синтез, применяют механизм РНК-интерференции. Это эволюционно консервативный механизм подавления генов за счет комплементарности между малой РНК и последовательностью РНК мишени. В ААВ можно поместить последовательность такой микроРНК или ее аналог — shRNA (small hairpin RNA, короткая шпилечная РНК), который будет выполнять в клетке те же функции. У данного подхода есть свои сложности. Существует опасность нецелевого подавления других генов. Кроме того, может наблюдаться высокая токсичность из-за того, что вся клеточная машинерия переключается на подавление одного гена, не выполняя свои рутинные функции. Данный подход по большей части находится на стадии доклинических исследований. Он может применяться не только для лечения генетических заболеваний, но и для подавления вирусных инфекций.
- Генное добавление (gene addition). Подход с потенциально широчайшим применением от терапии полигенных заболеваний до лечения инфекций. Это может быть доставка генов нейротрофических факторов в случае неврологических заболеваний, генов, регулирующих сигнальные пути при сердечной недостаточности или раке. ААВ может применяться для доставки генов, кодирующих рекомбинантные антитела против смертельных вирусных инфекций. Эта стратегия в настоящее время исследуется в клинике для лечения ВИЧ-инфекции (NCT01937455, NCT03374202).
- Генное редактирование (gene editing). Бурно развивающееся направление, позволяющее непосредственно редактироватьмутации, лежащие в основе болезней человека. Данная процедура, как правило, включает в себя 2 этапа: внесение разрыва в молекулу ДНК в нужном месте, и последующее восстановление, которое в конечном итоге приводит к желаемому изменению ДНК. Разработан ряд технологий редактирования, среди которых можно выделить наиболее популярную систему CRISPR/Cas (от англ. Clustered Regularly Interspaced Short Palindromic Repeats — короткие палиндромные повторы, регулярно расположенные группами). ААВ в данном случае выступает адресным курьером этой системы в поврежденные клетки. К трудностям данного подхода можно отнести большой размер генов cas. Кроме того, белки Cas бактериального происхождения, так что их иммуногенность может являться потенциальным препятствием. Тем не менее данную систему уже применяют в клинических исследованиях. Недавно было запущено клиническое испытание препарата на основе ААВ5 для лечения дегенеративного заболевания сетчатки, вызванного точечной мутацией в гене CEP290 (NCT03872479).
Производство ААВ
Когда речь идет о клинических испытаниях, требуется очень большое количество вирусного препарата высокого качества. Его производство — весьма нетривиальная задача.
Вирусы не могут самостоятельно себя воспроизводить, им необходима помощь клеточной машинерии. Для наработки ААВ стали использовать культуры клеток. Вариантов может быть много: использование культуры дрожжей (Saccharomyces cerevisiae), клеток насекомых (культура клеток Sf9 бабочки Spodoptera frugiperda), человека — HEK293, HeLa. Некоторые из этих подходов, — скорее, экзотика, но использование культур клеток млекопитающих (HEK293) или насекомых (Sf9) уже прочно закрепилось на производстве.
Итак, для начала необходимо определиться с методикой производства, ведь от этого зависит, в чем будет расти сама культура. Вариантов масса: для клеток, растущих, прикрепившись к субстрату, это могут быть большие чашки Петри, специальные сосуды с множеством перегородок для увеличения площади поверхности (рис. 6а). Для культур, хорошо чувствующих себя в виде суспензии и при постоянном перемешивании, — колбы, герметичные пакеты и многое другое. При увеличении масштабов производства можно переходить на специальные биореакторы (рис. 6б). С их помощью можно следить за целой панелью важных для процесса параметров. Они делают производство более технологичным и позволяют увеличить объемы продукции до нескольких сотен литров вирус-содержащей суспензии за один цикл работы.

Рисунок 6. Производство ААВ: на культуральных чашках (а) и в биореакторе iCellis Nano (Pall corporation) (б)
Что нужно сделать с культурой клеток, чтобы она стала биофабрикой по производству вирусных частиц? В такие клетки-производители вносят плазмидную ДНК, кодирующую необходимую для сборки вирусов информацию. Наиболее популярный протокол предполагает одновременное заражение клеток тремя плазмидами (рис. 7):
- Плазмидой с терапевтическим геном, который будет упакован в вирус и доставлен в клетки.
- Плазмидой, кодирующая rep- и cap-гены самого ААВ. Необходима для синтеза белков капсида и его последующей сборки.
- Плазмидой с генами вируса-помощника (хелпера).
Кстати, вместо третьей плазмиды может быть добавлен сам вирус-помощник (аденовирус или герпесвирус), как это было в более ранних протоколах по производству частиц ААВ.
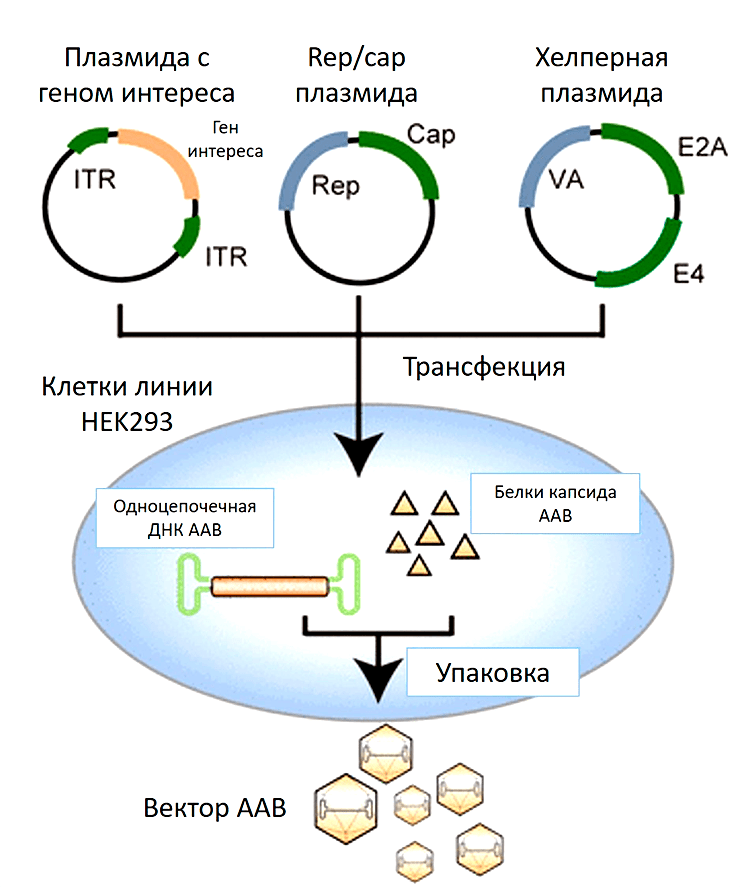
Рисунок 7. Производство ААВ, использующее в качестве клеток-производителей культуру клеток человека HEK293. Смесь трех плазмид доставляют внутрь клетки (плазмиду с терапевтическим геном, плазмиду, кодирующая гены rep/cap, и плазмиду с генами вируса помощника). Начинается наработка необходимых белков для сборки вирусных частиц. ДНК, содержащая терапевтический ген, упаковывается в готовый капсид ААВ.
Клетки начинают производить вирусные частицы, после чего их надо собрать и очистить.
Это критически важный этап, которому стоит уделить особое внимание. Любые примеси, которые будут содержаться в препарате, могут вызвать нежелательный иммунный ответ.
Вначале собирают сырой материал: это может быть клеточная среда, если вирусы выделяются клетками преимущественно в жидкость вокруг, а могут быть и сами клетки, если большинство вирусных частиц накапливается внутри. Как правило, это зависит от конкретного серотипа ААВ. Чтобы разрушить клеточные мембраны и высвободить вирус, клетки подвергают многочисленным циклам замораживания-оттаивания, ультразвуковой обработке или воздействию детергентов.
Теперь основная задача — очистить вирусные частицы от многочисленных примесей, находящихся в суспензии (рис. 8). В сыром материале находятся внутриклеточные свободные ДНК и РНК, белки и ферменты, крупные обломки клеточных мембран и многое другое. Способов очистки существует множество, и постоянно появляются как улучшенные версии уже применяемых методик, так и принципиально новые подходы. Все они различаются по уровням специфичности, эффективности и, разумеется, стоимости. Условно способы очистки можно разделить на серотип-специфичные и универсальные. К первой категории относится, например, аффинная хроматография, основанная на специфическом узнавании капсидов антителами. Ко второй — ультрацентрифугирование в градиентах плотности растворов йодиксанола или хлорида цезия, преципитация полиэтиленгликолем или сульфатом аммония, ионообменная хроматография и многие другие методы, основанные на общих физических свойствах вирусных частиц.
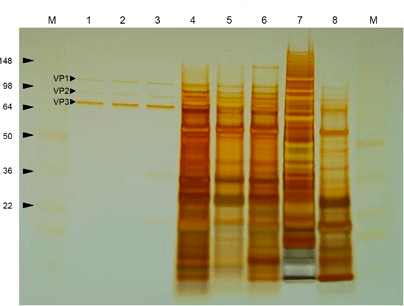
Рисунок 8. Окрашивание серебром очищенного (лунки 1–3) и загрязненного другими белками (лунки 4–8) препарата ААВ после гель-электрофореза.
Одна из неочевидных нежелательных примесей — так называемые пустые капсиды — вирусные частицы, не несущие в себе терапевтический ген, или содержащие внутри себя постороннюю ДНК. Дело в том, что изначально в клетке формируется пул пустых капсидов. Лишь потом ДНК связывается с пустым капсидом при помощи специальных сигналов на ITR и компактно упаковывается, формируя полноценную вирусную частицу. Но иногда пустой капсид может так и остаться пустым при нехватке вирусной ДНК или ее неэффективной упаковке. В пустой капсид может также упаковаться обрывок свободной ДНК, находящейся в клетке и содержащей последовательность, схожую с сигналом упаковки. Такие частицы (совсем пустые или несущие неправильную последовательность) не функциональны и подлежат удалению из очищаемого препарата. С определенной эффективностью их можно отделить от функциональных капсидов, используя градиенты плотности или методы хроматографии.
Основные проблемы
Главный барьер для широкого распространения генотерапевтических препаратов сегодня — чрезвычайно высокая стоимость. В настоящий момент «Золгенсма» представляет собой самое дорогое лекарство в мире ($2,1 млн за дозу). «Люкстурна» обойдется в $850 тысяч. Такая высокая цена обусловлена в равной степени сложным дорогостоящим производством, длительной трудоемкой разработкой и малым количеством пациентов.
Наработка большого количества плазмид высокой степени очистки, поддержание культур клеток, дорогостоящие реактивы, сложный процесс очистки вирусных частиц и разработка аналитических методик для характеризации препаратов ведут к таким космическим ценам при масштабировании производства. На стоимость также влияет серьезный контроль качества вирусного препарата. Чтобы препарат вышел на рынок, проводятся исследования его токсичности, безопасности, биораспределения, эффективности. Оценивается содержание белковых примесей, бактериальных эндотоксинов, количество пустых капсидов, стерильность препарата, концентрация вирусных частиц в растворе и множество других характеристик. В настоящий момент гиганты производств ААВ по всему миру работают над удешевлением препаратов, разрабатывая более эффективные протоколы сборки и очистки ААВ.
Иммунный ответ также представляет собой серьезную проблему. Потенциально иммунные реакции могут возникать на вирусный капсид, его геном, а также на белковый продукт трансгена. Препаратам на основе ААВ могут помешать нейтрализующие антитела к его капсиду. Связываясь с вирусами в кровотоке, антитела препятствуют проникновению вирусных частиц в клетки, что ведет к низкой эффективности препарата. В настоящий момент обязательно проводится скрининг пациентов на наличие антител к применяемому серотипу ААВ. В случае их обнаружения такой пациент исключается из клинических испытаний. Ведется разработка новых капсидов, которые не будут узнаваться нейтрализующими антителами. После доставки терапевтических доз ААВ быстро развивается гуморальный иммунный ответ, который впоследствии помешает повторному введению препарата. Именно поэтому большинство генотерапевтических препаратов на основе ААВ рассчитано на однократное введение. Для подавления Т-клеточного иммунного ответа у пациентов применяется фармакологическая супрессия стероидами.
Заключение
Генная терапия на основе ААВ — бурно развивающееся направление, и мы в данном обзоре затронули лишь небольшой кусочек этой удивительной области. Текущий экспоненциальный рост клинических испытаний с использованием ААВ предполагает, что мы находимся в самом начале эры новых генотерапевтических препаратов. Еще очень много задач предстоит решить, и для этого требуются мультидисциплинарные усилия. Дальнейшее развитие молекулярной биологии, биоинформатики, эпидемиологии, структурной биологии, иммунологии, геномики и других дисциплин, безусловно, будет способствовать совершенствованию технологии. Уже пройден длинный путь в попытке человечества победить генетические заболевания. Мы надеемся, что именно генная терапия приведет к окончательной победе!
Источник: БИОМОЛЕКУЛА

