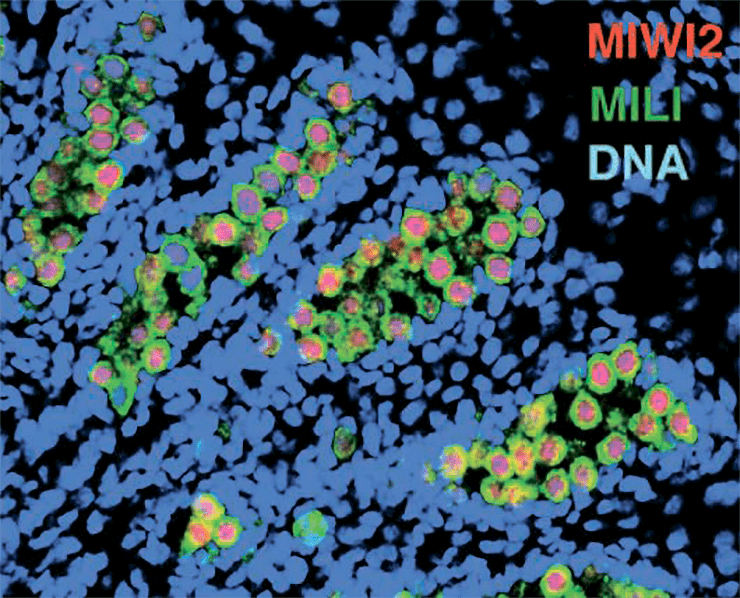
Белки группы Piwi (MIWI2 и MILI) в клетках семенников мыши. ДНК окрашена синим.
Главная функция систем CRISPR/Cas у прокариот — защита от вирусов и других мобильных генетических элементов. В ходе работы CRISPR/Cas в геном бактерии или археи вставляются небольшие фрагменты генома вируса или транспозона, которые необходимы для быстрого ответа при повторной атаке такого же вируса или мобильного элемента. У эукариотических организмов за защиту от транспозонов отвечают особые малые РНК — пиРНК, причем многие из них происходят от транскриптов, считываемых с так называемых эндогенных вирусных элементов. Наш обзор посвящен этой любопытной стратегии противовирусной защиты эукариот от мобильных генетических элементов, которая по принципу своей работы удивительно похожа на систему CRISPR/Cas прокариот.
Как известно, на гены, кодирующие белки, приходится совсем небольшая часть генома — не более нескольких процентов. А вот повторяющиеся последовательности и остатки мобильных генетических элементов составляют львиную долю нашего генетического материала. Практически любой эукариотический геном представляет собой «кладбище ретровирусов», поскольку каждая клетка несет в своей ДНК так называемые эндогенные вирусные элементы, бóльшая часть которых представляет собой остатки ретровирусов, когда-то интегрировавшихся в геном. Впрочем, есть в клеточной ДНК и небольшая доля последовательностей, происходящих от других вирусов, не относящихся к ретровирусам. Зачем же клетка тащит за собой из деления в деление такой большой груз некодирующих последовательностей и обломков вирусных геномов? Оказывается, многие эндогенные вирусные элементы локализованы внутри кластеров, кодирующих piRNA (piРНК) — особые некодирующие РНК, которые в комплексе с белками Piwi (отсюда и их название — Piwi-interacting RNA) препятствуют перемещению «живых» мобильных элементов по геному.
piРНК впервые описали в 2006 году у самцов плодовой мушки Drosophila melanogaster. Эти небольшие молекулы содержат около 30 нуклеотидов и активно взаимодействуют с нуклеазными белками группы Piwi (P-element induced wimpy testis). Как правило, piРНК закодированы в специальных локусах в геноме, однако идентифицировать их по последовательности или сведениям об экспрессии невозможно: единственным критерием принадлежности малой некодирующей РНК к piРНК является ее способность взаимодействовать с белками Piwi, которую можно выявить с помощью экспериментов по иммунопреципитации РНК-белковых комплексов (микроРНК, напротив, можно выявить на основе данных об экспрессии этих РНК и особенностях их биогенеза). piРНК транскрибируются в виде единого длинного транскрипта, который разрезается на отдельные короткие piРНК после транспортировки из ядра в цитоплазму. Самые первые piРНК получаются в результате разрезания транскрипта специальными белками (Aub, Vasa, AGO3 и Kimper у дрозофилы). Биогенез следующих генераций piРНК можно описать с помощью циклической схемы «пинг-понг»: piРНК в комплексе с белком Piwi комплементарно связывается с транскриптом транспозона, и после его разрезания белком Piwi фрагменты исходного транскрипта сами начинают функционировать как piРНК. Новые piРНК при участии белков Piwi запускают вырезание piРНК из транскрипта-предшественника piРНК, считанного с геномной ДНК (рис. 1).
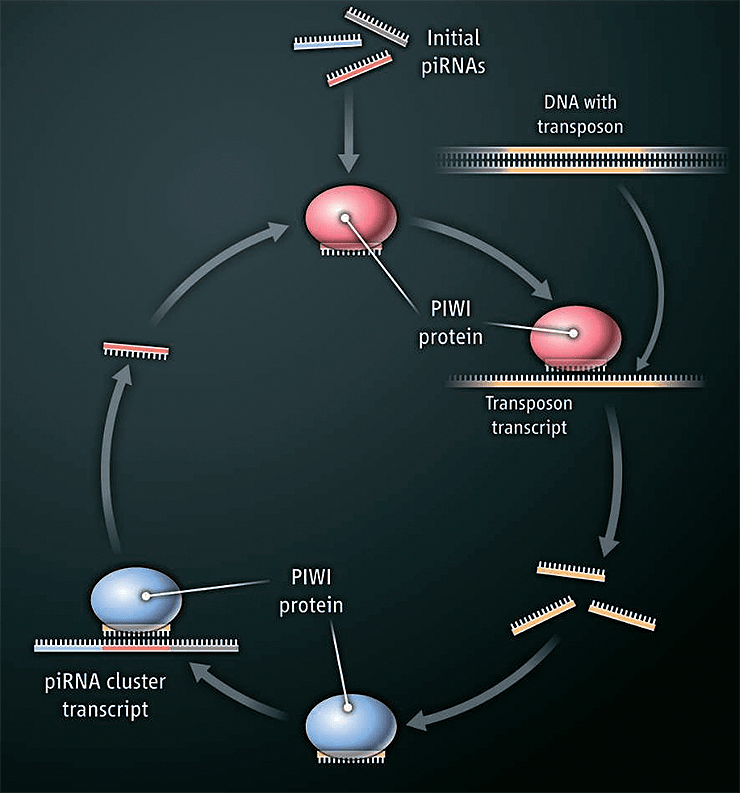
Рисунок 1. Цикл «пинг-понг» в биогенезе piРНК. piРНК, транскрибированные с геномной ДНК, связываются с транскриптами транспозона вместе с белком Piwi, который вносит разрез в мишень. Получающиеся фрагменты далее функционируют как piРНК, связываются с белками Piwi и обеспечивают вырезание комплементарных piРНК из транскрипта-предшественника piРНК.
piРНК нередко оказываются комплементарными последовательностям мобильных элементов, поэтому могут вызывать их сайленсинг (подавление экспрессии), связываясь с ними и «притаскивая» за собой белки Piwi. Таким образом, piРНК могут защищать геном только от перемещающихся элементов, поскольку кластеры piРНК транскрибируются в составе транскриптов транспозонов. Комплекс piРНК и белков Piwi (иногда называемый piRISC от англ. piRNA induced silencing complex) может вызывать сайленсинг мобильных элементов на уровне транскрипции с помощью эпигенетических модификаций (метилирования ДНК и модификаций гистонов) или вызывать разрушение соответствующих транскриптов транспозона в цитоплазме. piРНК функционируют в клетках зародышевой линии и некоторых соматических клетках у практически всех животных — от гидры до человека.
В 2010 году опять же на клетках дрозофилы показали, что piРНК могут происходить не только из транскриптов, считанных с транспозонов, но и от РНК-содержащих вирусов. На линии клеток яичника дрозофилы, зараженной несколькими РНК-вирусами, было продемонстрировано, что в ходе инфекции в клетках появлялись piРНК, вырезанные белками Piwi из вирусных транскриптов или даже непосредственно из вирусных геномов.
Защищают ли такие piРНК клетки от вирусов, от которых они произошли? Исследования, проведенные на дрозофиле, показали, что антивирусная активность piРНК проявляется только по отношению к вирусам, присутствующих в геномах клеток зародышевой линии, в остальных случаях убедительных свидетельств в пользу противовирусных свойств piРНК пока не удалось получить. Более результативными оказались исследования, проведенные на других насекомых — комарах рода Aedes. В культуре клеток комара, а также в соматических клетках и клетках зародышевой линии взрослого животного можно обнаружить множество piРНК, происходящих от РНК-вирусов из разных семейств. Примечательно, что заражение этими вирусами вызывает увеличение продукции piРНК в клетках комара, а нокдаун белков Piwi усиливает интенсивность размножения вируса. У других членистоногих, например, белокрылок, piРНК действуют и против ДНК-содержащих вирусов.
piРНК могут защищать организм не только от разнообразных вирусов. Показано, что у нематоды Caenorhabditis elegans белок PRG-1 из группы Piwi обеспечивает иммунитет к определенным бактериальным инфекциям, причем этот иммунитет может передаваться из поколения в поколение. Более того, у червей, инфицированных бактериями, повышается экспрессия piРНК, которая вызывает изменения и в самом организме нематоды. Так, у червей, родители которых переболели определенными бактериальными инфекциями, имеются нарушения экспрессии генов в нейронах и, как следствие, нарушения в поведении.
А что piРНК делают у млекопитающих? По-видимому, они тоже каким-то образом замешаны в защите от вирусов, хотя убедительное участие в противовирусных механизмах пока удалось продемонстрировать только для белков Piwi. Так, белок PIWIL2 подавляет репликацию ВИЧ-1 в культуре T-лимфоцитов человека. Есть предположение, что белки Piwi подавляют интеграцию вируса герпеса человека 6 типа в области теломер, однако экспериментальных свидетельств пока эта гипотеза не получила. У людей бóльшая часть piРНК не связана с перемещениями транспозонов и комплементарна только тем локусам, с которых она синтезируется. Некоторые авторы проводят параллель между кластерами piРНК у человека и спейсерами CRISPR: происхождение последних тоже долгое время оставалось загадкой, пока не было установлено, что они представляют собой кусочки вирусных геномов и мобильных генетических элементов (рис. 2). Может быть, кластеры piРНК тоже состоят из небольших кусочков вирусных геномов, подобно спейсерам в CRISPR? Действительно, в 2015 году появилось сообщение, что в геномах мыши, крысы и мармозетки существует особая группа эндогенных вирусных элементов, не связанных с ретровирусами, которые локализованы в пределах кластеров piРНК. Эти элементы происходят от вирусов, похожих на борнавирусы, геном которых представлен одноцепочечной РНК. Примечательно, что направление транскрипции piРНК с борнавирусоподобных эндогенных элементов таково, что транскрипт оказывается комплементарным мРНК, которые также считываются с этих элементов и кодируют древний борнавирусный нуклеопротеин. Напрашивается очередная параллель с CRISPR/Cas: crРНК также считываются с фрагментов вирусного происхождения, вставленных в геном. Таким образом, можно заключить, что когда-то piРНК возникли как механизм сайленсинга генов борнавируса. Примечательно, что расположение борнавирусных элементов у грызунов и приматов синтенично (с сохранением порядка генов), то есть иммунитет к борнавирусу, обеспечиваемый piРНК, вполне мог передаваться вертикально — от родителей к потомкам.
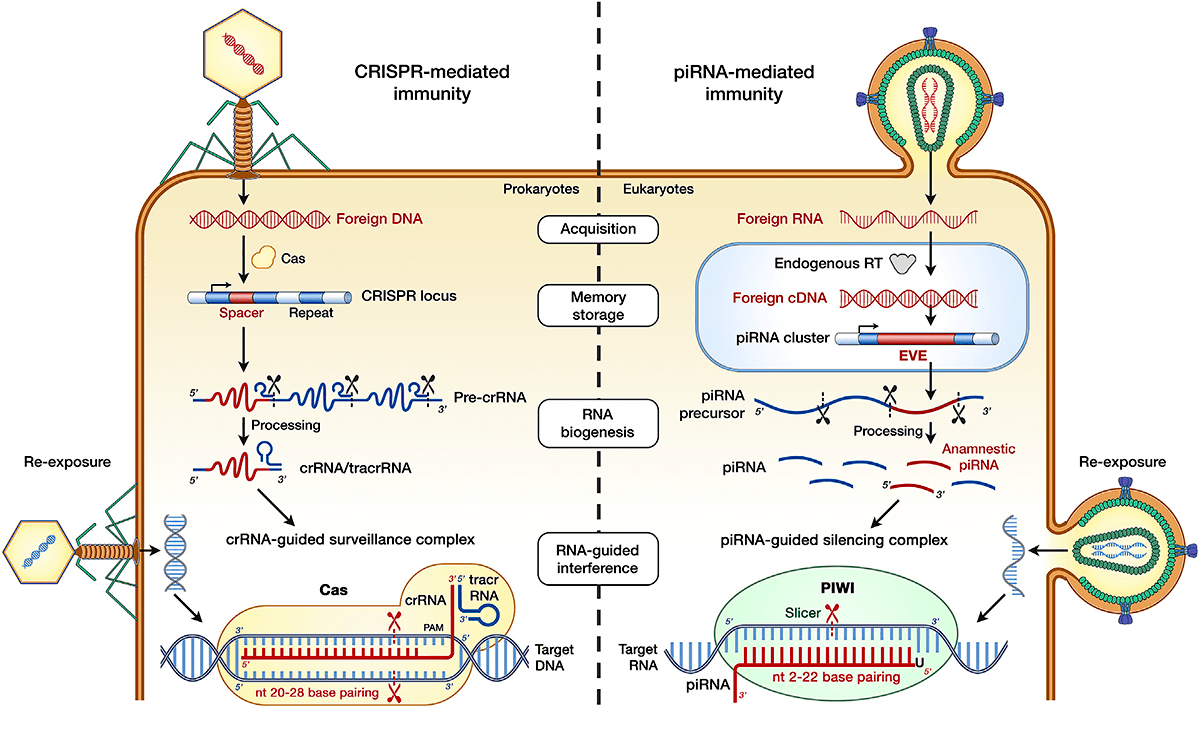
Рисунок 2. Сравнение системы CRISPR/Cas прокариот (слева) и piРНК эукариот (справа). В обоих случаях в геном встраивается фрагмент чужеродной ДНК, который передается от материнской клетки к дочерним в составе геномной ДНК. С этого фрагмента считываются малые некодирующие РНК (crРНК или piРНК), которые в комплексе с эффекторными белками (Cas или Piwi) осуществляют сайленсинг экспрессии гена вируса посредством комплементарного взаимодействия при его повторном проникновении.
У комаров Aedes эндогенные вирусные элементы также часто обнаруживаются в пределах кластеров piРНК, причем, подобно описанной выше ситуации с борнавирусными элементами, считывающиеся с них piРНК оказываются комплементарными РНК вирусов, давших начало этим элементам. Обогащение кластеров piРНК неретровирусными эндогенными элементами, похоже, вообще характерно для членистоногих: из 48 проанализированных геномов членистоногих в 30 наблюдалось обогащение кластеров piРНК эндогенными вирусными элементами. Впрочем, пока что делать глобальные выводы на основании имеющихся данных о piРНК членистоногих преждевременно: для эффективного сайленсинга необходима высокая степень комплементарности piРНК и ее мишени, однако в тех случаях взаимодействия piРНК с вирусными транскриптами, которые удалось выявить, piРНК была далеко не полностью комплементарна вирусной мРНК и, следовательно, не могла участвовать в сайленсинге. Вполне вероятно, что вирусы членистоногих эволюционировали таким образом, чтобы снизить степень комплементарности piРНК к своим мРНК.
Однако самый яркий пример противовирусной активности piРНК можно найти у домашних кур. Куры были подвержены особому вирусному лейкозу, который вызывает ретровирус ALV (от англ. Avian leukosis virus), однако еще до одомашнивания они приобрели особый эндогенный вирусный элемент ALVE6, обеспечивающий защиту от вируса, от которого он произошел. С ALVE6 считываются piРНК, которые подавляют репликацию вируса. Похожую ситуацию можно наблюдать у коал, у которых с элементов ретровирусного происхождения считываются piРНК, подавляющие размножение исходного вируса.
Таким образом, piРНК на самом деле могут быть не эксцентричным защитным механизмом, присущим только клеткам зародышевой линии, а мощным инструментом защиты эукариотических клеток от вирусов и транспозонов, причем механизм их действия очень близок к принципу действия прокариотических систем CRISPR/Cas. Можно даже сказать, что piРНК — это древний механизм противовирусной защиты, появившийся у эукариот как аналог CRISPR/Cas. Однако, к сожалению, мы пока не располагаем достаточным объемом непротиворечивых экспериментальных данных, чтобы распространять это предположение на всех эукариот.
Источник: БИОМОЛЕКУЛА

