
Хотя основное назначение систем CRISPR/Cas состоит в обеспечении защиты от вирусов клеток бактерий и архей, сами вирусы прокариот могут использовать эти системы для конкурентной борьбы друг с другом.
Сейчас сложно найти молекулярного биолога, который бы не знал про систему CRISPR/Cas, обеспечивающую адаптивный иммунитет бактерий и архей против вирусов и мобильных генетических элементов. Впрочем, накапливается масса свидетельств и о других функциях CRISPR/Cas. Так, недавно группа исследователей, показала, что системы CRISPR/Cas могут использовать вирусы гипертермофильных архей в конкурентной борьбе друг с другом. Такие вирусные системы не имеют генов cas, зато содержат локусы CRISPR с несколькими спейсерами, соответствующими фрагментам генома вируса-конкурента. Как же работают вирусные «мини-CRISPR»?
Гипертермофильные археи и их вирусы
Классической функцией систем CRISPR/Cas является защита клеток бактерий и архей от вирусов и других мобильных элементов. Впрочем, описана масса случаев, в которых варианты этой системы присутствуют в составе бактериофагов, плазмид и транспозонов.
Однако наиболее сложно устроенными системами CRISPR/Cas обладают гипертермофильные археи порядка Sulfolobales. Они имеют локусы CRISPR с различными повторами, несколько функциональных комплексов, ответственных за этап адаптации (то есть вставки новых спейсеров), а также эффекторные модули двух типов, которые и разрушают чужеродную ДНК. Столь сложная система защиты от вирусов нужна этим археям не просто так: их вирóм (то есть совокупность всех поражающих их вирусов) чрезвычайно разнообразен, и по крайней мере некоторые из вирусов, инфицирующих архей этой группы, имеют особые белки, блокирующие работу систем CRISPR/Cas (их называют системами анти-CRISPR).
Группа исследователей во главе с Мартом Круповичем из Института Пастера (Франция) провела глубокий анализ спейсеров в локусах CRISPR архей рода Saccharolobus (раньше он был известен как Sulfolobus) с помощью высокопроизводительного секвенирования. Для анализа были взяты как образцы, полученные непосредственно из природных местообитаний этих архей, так и образцы культур Saccharolobus, выращенных из этих же образцов. Анализ разнообразия спейсеров гипертермофильных архей принес несколько интересных результатов.
Во-первых, оказалось, что спейсеры архей рода Saccharolobus, взятых из разных мест, различаются и соответствуют именно тем вирусам, с которыми археи сталкиваются в природных условиях. Следовательно, с помощью анализа спейсеров гипертермофильных архей можно установить биогеографию поражающих их вирусов.
Во-вторых, анализ спейсеров культур гипертермофильных архей, инкубировавшихся в лабораторных условиях, в разные моменты времени позволил примерно оценить временную динамику «спейсерного состава» локусов CRISPR.
В-третьих, выяснилось, что самые многочисленные спейсеры в образцах принадлежат вовсе не археям, а поражающим их вирусам, которые используют эти спейсеры, а также белки Cas археи-хозяина в конкурентной борьбе друг с другом. Но обо всем по порядку.
CRISPR/Cas как механизм конкуренции близкородственных вирусов
Исследователи изучали популяцию архей Saccharolobus, обитающих в термальном поле Беппу в Японии. Анализ спейсеров проводили в двух образцах, полученных непосредственно из природных местообитаний (их обозначили J14 и J15), а также в выращенных из них накопительных культурах. Для этого спейсеры предварительно амплифицировали посредством ПЦР, причем для ПЦР брали праймеры, соответствующие уникальным для Sulfolobales повторам из локусов CRISPR. Далее с помощью высокопроизводительного секвенирования из всех образцов получили последовательности более чем 25 миллионов спейсеров. Бóльшая часть ПЦР-фрагментов включала 2–3 единицы «спейсер—повтор» и была отсеквенирована более 100 раз. С помощью перекрывающихся спейсеров эти единицы удалось собрать в более протяжённые локусы CRISPR.
Однако откуда происходят отсеквенированные спейсеры — из геномов архей, поражающих их вирусов или других мобильных генетических элементов? Лишь для приблизительно 6% спейсеров удалось установить исходные последовательности (протоспейсеры), из которых они возникли. Спейсеры архей из Беппу соответствуют 53 вирусным геномам, которые были обнаружены в разных частях планеты, однако бóльшая часть спейсеров приходится именно на те вирусы, которые также обитают в Беппу. Действительно, нужнее всего археям спейсеры против тех вирусов, с которыми они постоянно контактируют.
Ученые также рассмотрели, как меняется состав спейсеров в локусах CRISPR (его назвали «CRISPRóм») с течением времени. Они наблюдали, что происходит с CRISPRомом культур, полученных из образцов J14 и J15, по мере их роста в одних и тех же лабораторных условиях. Изначально спейсерный состав в обоих случаях был примерно одинаков, однако с течением времени в их CRISPRомах начали появляться существенные различия. По предположению исследователей, это связано с различиями в вирусных популяциях, попавших в образцы. Действительно, образцы J14 и J15 содержали разные, хотя местами и перекрывающиеся, наборы вирусов. Наиболее многочисленным вирусом в образце J14 был вирус SPV1 (Sulfolobus alphaportoglobovirus 1), а в образце J15 — SPV2. Оба этих вируса, как оказалось, содержат собственные локусы CRISPR с двумя-тремя спейсерами, которые исследователи назвали «мини-CRISPR». Геномы SPV1 и SPV2 на 92% идентичны, причем различия касаются преимущественно спейсеров в составе мини-CRISPR. Именно из геномов этих вирусов, а не из геномов архей, происходят шесть самых часто встречающихся спейсеров в образцах. Более того, выяснилось, что два из трех спейсеров, присутствующих в мини-CRISPR вируса SPV1, направлены против SPV2, а один из трех спейсеров SPV2 направлен против SPV1. Видимо, именно по этой причине в образцах присутствовал только один из этих двух вирусов, но не два вируса одновременно. Поскольку собственных генов cas у обоих вирусов нет, для борьбы друг с другом они пользуются белками Cas клетки-хозяина (рис. 1).
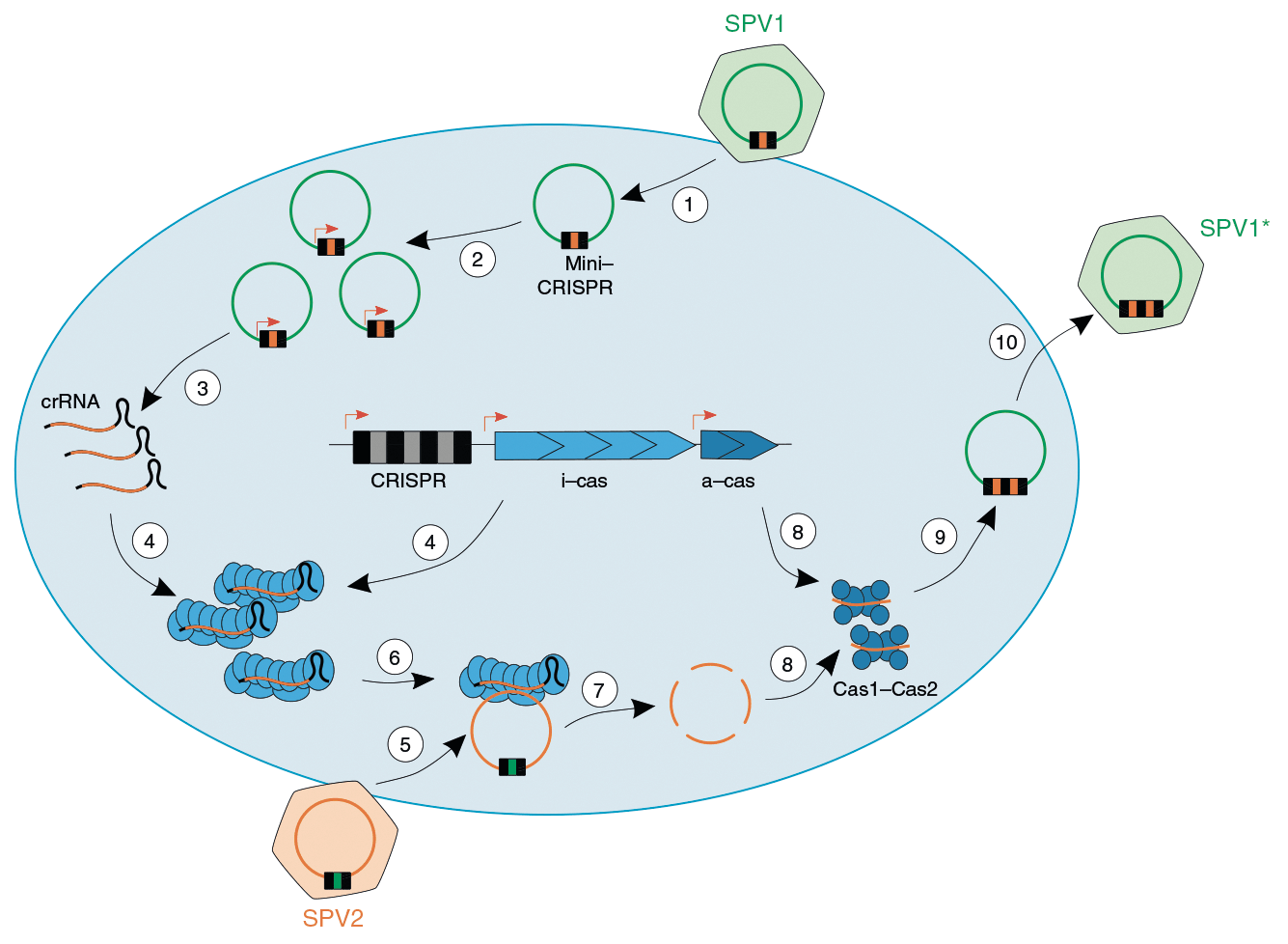
Рисунок 1. Вероятный механизм «войны» двух близкородственных вирусов — SPV1 и SPV2 — внутри клетки гипертермофильной археи. 1. SPV1, имеющий спейсер, направленный против SPV2, инфицирует клетку. 2. Геном SPV1 (и мини-CRISPR вместе с ним) реплицируется, спейсеров против SPV2 становится больше. 3. Со спейсеров SPV1 начинает считываться crРНК. 4. Вирусные crРНК взаимодействуют с эффекторными белками Cas археи. 5. SPV2 инфицирует ту же самую клетку. 6 и 7. Геном SPV2 распознается благодаря crРНК, считанным со спейсеров SPV1, и разрушается белками Cas археи. 8. Фрагменты генома SPV2 взаимодействуют с клеточными белками Cas1 и Cas2, ответственными за этап приобретения новых спейсеров (адаптации). 9. В мини-CRISPR SPV1 вставляется новый спейсер, взятый из генома SPV2. 10. Клетку покидает новый вариант SPV1 с дополнительным спейсером против SPV2.
Стоит отметить, что геномы SPV1 и SPV2 очень близки, и в них содержатся фрагменты, ортологичные спейсерам, направленным против другого вируса. Если спейсеры вируса будут идентичны участкам его собственного генома, то вирус может уничтожить сам себя. Чтобы избежать такого исхода, участки, ортологичные спейсерам, несут точечные мутации или делеции, препятствующие их распознаванию crРНК. Примечательно, что, хотя в геномах архей тоже есть спейсеры, нацеленные против SPV1 и SPV2, они менее специфичны и нацелены против обоих вирусов одновременно. А вот спейсеры самих вирусов действуют строго против вируса-конкурента.
Исследователи не остановились на SPV1 и SPV2 и продолжили поиск мини-CRISPR в геномах других вирусов, содержащихся в образцах. Поиск принес свои плоды: по меньшей мере 15 вирусов архей, отличных от SPV1 и SPV2, но близких к ним, имеют собственные мини-CRISPR, причем из 26 спейсеров, суммарно входящих в их состав, 18 нацелены на разные участки геномов SPV1 и SPV2. Мини-CRISPR были выявлены и у некоторых других, неродственных вирусов архей.
Таким образом, ученым удалось выявить еще один механизм, который вирусы, поражающие один и тот же вид, используют в конкурентной борьбе друг с другом. Он же может лежать в основе феномена исключения суперинфекции: клетку заражает только один из вирусов-конкурентов, но не два вируса одновременно. Важно отметить, что вирус SPV1 не относится к числу литических, то есть не вызывает быструю гибель клетки, а довольно долгое время может мирно с ней сосуществовать. Поскольку SPV1, содержащийся внутри клетки, не убивает ее и обеспечивает защиту от SPV2, подобные отношения между SPV1 и клеткой археи можно рассматривать как своеобразный случай взаимовыгодного симбиоза. Более того, необходимость точечных замен и делеций для предотвращения действия вирусных CRISPR против собственного генома служит дополнительным стимулом повышения разнообразия и эволюции вирусов.
Вирусные мини-CRISPR: что дальше?
Первый автор исследования Софья Медведева, считает, что осталось еще множество вопросов относительно вирусных мини-CRISPR, на которые пока нет ответа: «Пока неизвестно, как вирусы SPV приобретали мини-CRISPR? Вероятно, заимствование CRISPR-кассеты из генома хозяина происходило неоднократно. Предполагается, что мини-CRISPR могут приобретать новые спейсеры, используя белки Cas клетки. Но почему же мини-CRISPR не разрастаются до полноразмерных CRISPR-кассет? Кроме того, часть спейсеров из генома археи-хозяина направлена против вирусов SPV. Как же они избегают узнавания и разрушения CRISPR-системой хозяина? Ведь если SPV заблокирует действие CRISPR-системы, например, с помощью анти-CRISPR-белков, то и против вируса-конкурента неактивная CRISPR-система будет бесполезна. Также остается неясным, как вирус отличает собственную ДНК от ДНК вируса-конкурента при встраивании новых спейсеров в свои мини-CRISPR? Если новые спейсеры выбираются из собственного генома, то бóльшая часть популяции SPV в клетке погибает», — рассказывает Софья.
Источник: БИОМОЛЕКУЛА

