Традиционные подходы к лечению всевозможных патологий сопровождаются проникновением лекарства через физиологические отверстия и кровеносные сосуды в организм больного человека. Проникая в кровь, лекарство действует на весь организм, взаимодействуя со всеми клетками на своем пути. Однако для более эффективной работы препарата и устранения побочных эффектов необходимо как осуществить адресную доставку вещества в нужное место, так и обойти ферментные системы организма, способные превратить лекарственный препарат в его неактивную или токсическую форму.
По пути в пункт назначения
Окружающий мир полон организмов, состоящих из множества различных клеток, чья судьба определяется собственной генетической программой. На основе этих программ клетки объединяются друг с другом в нужном месте и в нужное время, образуя многообразие тканей и органов. При этом на разных этапах жизни организма появляются и накапливаются всевозможные патологии, организм стареет и со временем умирает. Для восстановления поврежденных клеток люди давно уже пытаются найти способ доставлять лекарства непосредственно в пораженный орган организма человека (предварительно вылечив в экспериментах множество червей, мух и мышей). Так, если препарат нужно доставить в печень, то проблем нет: всё так или иначе проходит через нее. С поверхностными органами и опухолями тоже сложностей нет, их можно лечить локально. Проблема появляется, когда нужно тканеспецифически доставить лекарство в определенное место: в эндокринную часть поджелудочной железы, в щитовидную железу, надпочечник или куда-нибудь еще вглубь организма, при этом, по возможности, не затронув другие органы. Путь любого препарата, попавшего в организм человека, лежит через печень и почки, где он включается в метаболические пути и в разной степени нарушает их функции, повышая нагрузку на них.
Для того чтобы лекарственный препарат меньше разрушался в организме и дошел до своего места назначения, можно прикрепить его к маленькому носителю — например, наночастице, которая «спрячет» лекарство на своей поверхности и защитит его от расщепления ферментами. После связывания с наночастицей стабильность препарата возрастает, и наночастица доставляет препарат в нужный орган, высвобождая его при изменении pH, температуры, взаимодействии с молекулами на целевой клетке, под действием облучения или какого-либо другого стимула. Однако пока не достигнута специфичность высвобождения препарата только в пораженной ткани, емкость наночастиц ограничена и большинство из них, как правило, не биосовместимы. Неорганические наночастицы и наночастицы на основе углеродных нанотрубок и графена при их использовании как системы адресной доставки могут накапливаться в организме человека, вызывая воспалительные реакции, аутоиммунные заболевания, предраковые изменения и фиброз тканей. В то же время эффект «повышенной проницаемости и удержания» наночастиц в опухоли, связанный с ее усиленным кровоснабжением и затрудненным оттоком жидкости через лимфатические сосуды, работает не во всей опухоли (в связи с ее неоднородностью).
Для увеличения емкости доставки препарата и защиты от агрессивной среды организма можно его поместить в маленькие липидные пузырьки — липосомы. Их липидный бислой, как и у биомембран, образован полярными головками, направленными в водную среду, и гидрофобными хвостиками, ориентированными друг к другу. Наличие на поверхности липосомы необходимых мембранных белков и векторов для доставки придает им возможность с одной стороны доставляться до нужного адреса, а с другой — выполнять различные ферментативные реакции в месте назначения. Однако получение липосом с мембранными белками — непростая задача из-за проблем с выделением, очисткой и встраиванием мембранных белков в липосому.
Чтобы повысить специфичность взаимодействия липосом с целевыми клетками, к ним пробовали крепить пептиды, антитела и рецепторы, но это мало помогло. Выяснилось, что простого физического контакта между липосомой и клеткой недостаточно, чтобы запустить их слияние. В основном липосомы попадают в целевые клетки путем эндоцитоза (без непосредственного слияния с клеточной мембраной), когда липосома «заглатывается» клеткой и далее сливается с лизосомой. При этом лекарство, контактируя с лизосомными ферментами, может разрушиться, потеряв свою активность или даже приобретя нежелательную побочную активность.
Можно выделить два требования к системе доставки лекарств: специфичность доставки в целевые клетки и прохождение внутрь клетки вне лизосомального пути, путем слияния биологических мембран системы доставки и клетки.
Итак, выбранная нами система доставки должна не только хорошо проникать в клетки, но и различать свое место назначения. Перемещаясь в кровеносных сосудах, можно ориентироваться только на поверхность клеток эндотелия и, как показывают последние исследования, такие клетки в разных тканях наделены различными уникальными фенотипическими и функциональными признаками. Уникальное для каждого органа сочетание факторов транскрипции, ангиокринных факторов роста, рецепторов, молекул адгезии и хемокинов обеспечивает разделение эндотелиальных клеток на различные органоспецифические популяции. При этом ангиокринные факторы и органотипические свойства эндотелия обеспечивают направленность систем доставки в нужное место. Осталось только преодолеть барьер и слиться с нужной клеткой.
Преодолевая барьеры
Эксперименты in vitro показали, что слияние липидных бислоев, имитирующих биомембраны, требует затрат энергии. В результате даже тесные и длительные контакты между мембранами в физиологических условиях не приводят к слиянию мембран. С точки зрения эволюции, слияние мембран — процесс, который никогда не должен происходить «без ведома» клетки. Случайное слияние может привести к серьезным проблемам для нормального функционирования человеческого организма, а ведь именно многоклеточность и различия между нашими тканями делают нас людьми. Трудно представить ситуацию, когда огромная многоядерная амеба или миксомицет сможет осуществить разделение функций внутри своей огромной многоядерной клетки. Независимо от сложности системы, слияние, по существу, сопровождается взаимодействием различных межфазных сил: гидратационного отталкивания, гидрофобного притяжения «хвостов» липидов мембран и сил Ван-дер-Ваальса (рис. 1).
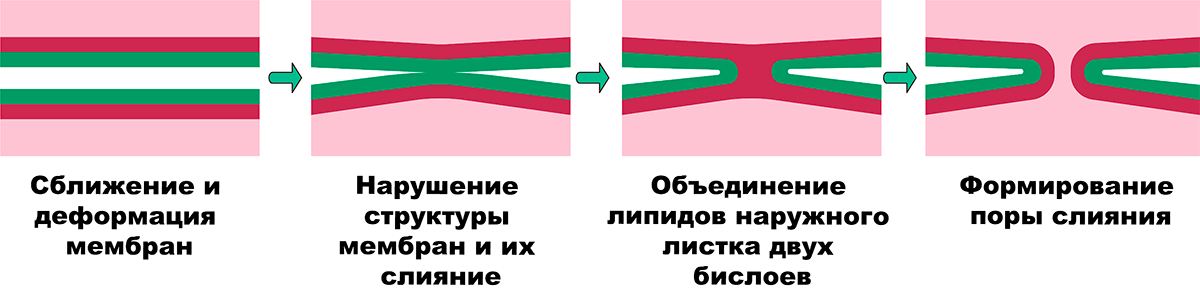
Рисунок 1. Слияние биологических мембран. При сближении друг с другом два липидных бислоя испытывают слабые силы притяжения Ван-дер-Ваальса и гораздо более сильные силы отталкивания из-за взаимодействия полярных групп фосфолипидов и молекул воды, покрывающих бислои. Каждая молекула воды может формировать до четырех связей с соседними водными молекулами, но для этого вода должна находиться «в толще воды». Поскольку молекулы воды имеют сродство к гидрофильным группам фосфолипидов, они располагаются вокруг них, формируя на поверхности мембраны упорядоченный слой, который очень трудно снять с поверхности мембраны. В итоге одновременно два гидратированных бислоя контактирующих мембран испытывают сильное отталкивание и слабое притяжение друг к другу. «Сила гидратации» резко возрастает, когда бислои сближаются на 20 Å и меньше, и мембраны отталкиваются. Однако дальнейшее сближение мембран приводит к ослаблению отталкивания: происходит «обезвоживание» поверхностей и образование поры слияния, формируется водный мостик, и внутреннее содержимое двух структур объединяется.
Какая нормальная соматическая клетка человека добровольно займется слиянием с другой? Правильно, никакая. Силы, скрепляющие клетки между собой, не способствуют слиянию мембран. В природе не известно случаев, когда клетки использовали бы для своего слияния всевозможную «химию»: относительно высокие концентрации кальция или высокие концентрации ПАВ, таких как полиэтиленгликоль, которые используются экспериментаторами при слиянии клеток in vitro. В природе слияние биологических мембран обеспечивается специальными белками слияния.
Первыми, кто научился сливать биологические мембраны, оказались вирусы. Их судьба, как внеклеточных форм жизни, неразрывно связана с клетками: там они размножаются и идут дальше в поисках нового дома. Многие вирусы, такие как респираторный синцитиальный вирус человека, вирус гриппа и ВИЧ научились эффективно сливаться с целевой клеткой и формировать синцитий или симпласт из них. Для своего выживания и функционирования вирусам нужно проникнуть в как можно большее количество клеток и распространиться повсеместно во всей популяции. Если клетки живут поодиночке, то распространить себя массово трудно, и необходимо каждый раз выходить наружу из клетки и искать новый дом. Если же клетки формируют колонии или живут в тесных сообществах, есть прекрасный выход, заключающийся в формировании «цитоплазматических мостиков» между клетками и в перспективе — формировании синцитиев. Если плотность популяции клеток хозяев недостаточна для формирования уютного синцития или хочется пойти дальше по организму, то это можно делать или в других клетках (лейкоцитах) или во внеклеточных везикулах и экзосомах — небольших (30–100 нм) мембранных пузырьках, высвобождаемых клетками во внеклеточную жидкость для межклеточной коммуникации.
При формировании экзосом клеточная мембрана впячивается внутрь и включает мембранные белки в направлении, противоположном ориентации клеточной мембраны, с формированием эндосомы. Далее эндосомы еще раз впячиваются внутрь, превращаясь в мультивезикулярные тела, содержащие множественные везикулы/экзосомы, в которых мембранные белки имеют правильную ориентацию. Экзосомы в основном обогащены небольшими некодирующими РНК, в том числе микроРНК, а также могут содержать мРНК, ДНК и белки. Некоторые исследования показывают, что экзосомы могут снижать апоптоз, влиять на развитие воспаления, рака, нейродегенеративных заболеваний и состояние миокарда и могут использоваться как потенциальные терапевтические системы доставки для лечения различных патологий. Вирусы могут использовать существующие пути межклеточной коммуникации, основанные на экзосомах и внеклеточных везикулах, для заражения новых клеток. Так, например, экзосомы макрофагов, инфицированных вирусом гепатита А, несут на своей поверхности белки, направляющие их в клетки печени — гепатоциты. Таким образом, вирусы научились манипулировать системами формирования экзосом и внеклеточных везикул. Получается, что вирусные белки слияния с одной стороны могут способствовать фрагментации клеток с образованием внеклеточных везикул или экзосом, а с другой — умеют объединять мембраны. Что же собой представляют эти белки слияния?
На заре появления первых эукариот эволюция придумала выход для преодоления высокоэнергетического барьера к слиянию мембран — белки слияния. На рисунке 2 представлена схема взаимодействия и принцип работы белков слияния мембран. Обычно это белки капсидов вирусов, широко представленные в различных семействах вирусов (например, Orthomyxoviridae, Retroviridae, Paramyxoviridae, Coronaviridae, Filoviridae). При этом эффективность работы таких белков неодинакова у разных вирусов и наиболее выражена у белков вируса ЧРСВ, gp2 вируса Эбола, gp37 вируса саркомы Рауса и gp41 вируса иммунодефицита человека типа 1 (ВИЧ-1). Как правило, такие вирусные белки слияния консервативны, обладают слабыми антигенными свойствами и обеспечивают, автономно или совместно с корецепторными молекулами, связывание и слияние с целевой мембраной в нужной ткани. Зараженные этими вирусами клетки сливаются друг с другом и образуют синцитий, что приводит к формированию огромных многоядерных клеток. Этот процесс обусловлен взаимодействием поверхностных вирусных белков слияния непосредственно на мембране клетки-хозяина.
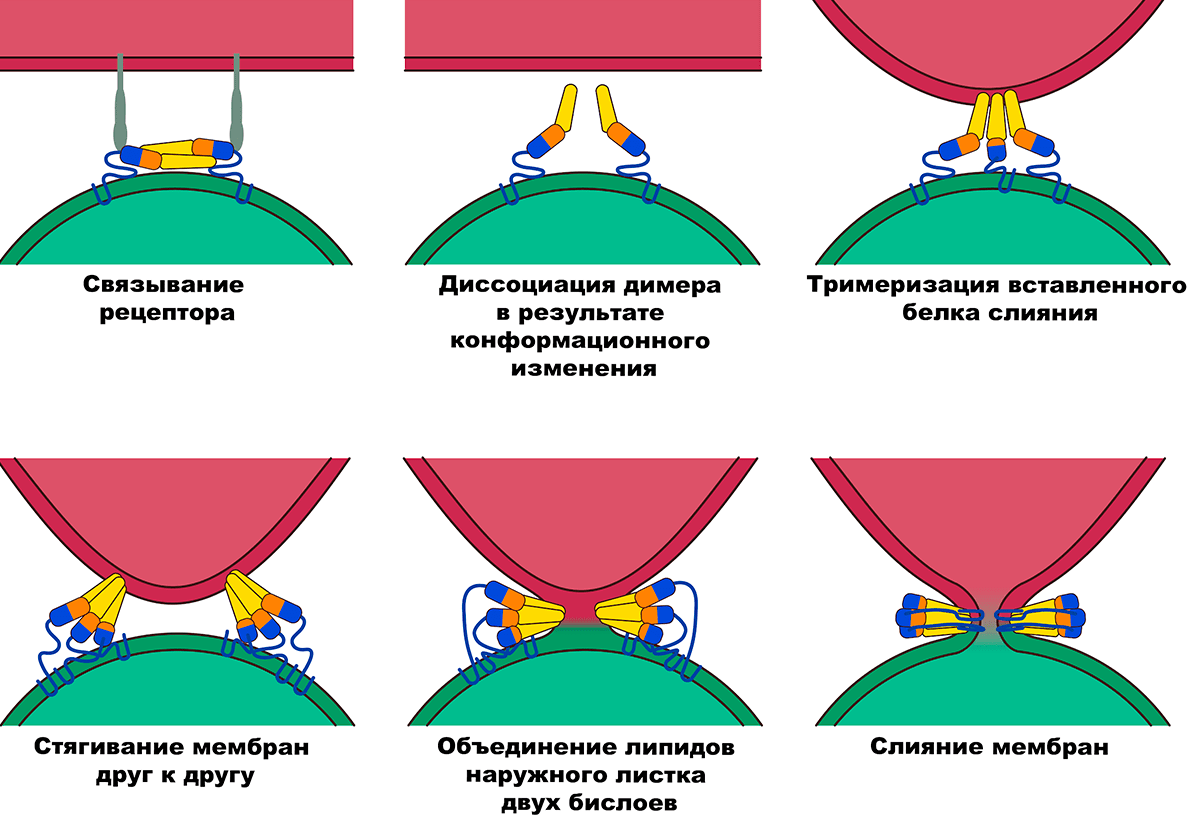
Рисунок 2. Схема конформационных изменений белков слияния и взаимосвязи между конформационным переходом и изменениями в двух сливающихся мембранах
Как эти белки определяют, с какой мембраной нужно слиться? В качестве ориентира для определения своего местоположения и направления движения вирусы используют рецепторы на поверхности клеточных мембран хозяев. Путь проникновения вирусов в организм животных лежит через различные слизистые оболочки и кровь. В зависимости от способа проникновения в клетки существует несколько механизмов активации таких белков. В одном варианте активации белков слияния связывание вирусной оболочки с целевой клеткой запускает процесс эндоцитоза, и вирусы попадают в эндосому. Внутри клетки эндосомы в свою очередь сливаются с лизосомами, pH среды падает, и белки слияния претерпевают конформационные изменения, приводящие к связыванию и протыканию изнутри мембраны лизосомы. Именно благодаря такому связыванию и формированию перешейка между вирусной оболочкой и внутренней поверхностью мембраны лизосомы, у вирусных белков и нуклеиновых кислот появляется возможность проникнуть в уютное ядро клетки. Другие механизмы активации белков слияния предполагают использование корецептора или рецепторов на поверхности клетки, в которую проникает вирус.
Белки слияния, будучи изначально орудием вирусов для проникновения в клетки хозяев, нашли себя и в других организмах. Конечно, против вирусов работают врожденный и приобретенный иммунитеты, максимально элиминирующие распространение инфекции. Но вирусы и всевозможная чужеродная ДНК не просто сидят в клетке, а интегрируются в геном как внехромосомные элементы или даже встраиваются в ДНК хозяина (так поступают ретровирусы). Как бы ни старалась клетка ограничить поток чужеродных генов, окружив свою ДНК ядерной оболочкой и всевозможными нуклеазами, чужеродные гены выстраиваются, эволюционируют и в некоторых случаях включаются в жизнь клетки (рис. 3).

Рисунок 3. Я/мы эндогенные вирусные элементы
В ходе эволюции эукариоты приобретали новые гены, используя различные пути и механизмы. Эти гены попадали в ядерный геном и включались в метаболические и регуляторные пути клетки. Некоторые из этих генов позволили внутриклеточным симбионтам приобрести способность к слиянию, что вообще не свойственно для клеток бактерий и архей. В мире существует огромное количество (по суммарной массе) внутриклеточных структур — митохондрий, способных к регулярному слиянию и делению внутри клетки. Эти динамичные структуры практически полностью утратили свою автономность, оставив себе малую часть генов, и интегрировались в метаболизм клетки хозяина. Их белки слияния подобны вирусным белкам и опосредуют слияние наружных мембран с последующим объединением в единое целое. Слияние митохондрий позволяет равномерно распределить генетический материал между ними и поддержать состояние гетероплазмии (наличия нескольких митохондральных геномов внутри клетки). Слияние наружной митохондриальной мембраны контролируется белками митофузинами. Один из доменов этих белков, HR1, облегчает слияние мембран путем дестабилизации структуры липидного бислоя, преимущественно в мембранных областях, имеющих дефекты упаковки липидов.
Митохондрии занимаются слиянием регулярно и постоянно, но не они одни. Весь внутриклеточный везикулярный транспорт основан на нацеливании везикул в пункт назначения с помощью, например, SNARE-белков (растворимых рецепторов прикрепления N-этилмалеимид-чувствительного фактора), также родственных вирусным белкам слияния. Эти белки обеспечивают распознавание и связывание мембран, которым суждено слиться. Все SNARE-белки имеют в своем цитозольном домене сегмент, называемый SNARE-мотивом. Заякоренные белки встраиваются в плазматическую мембрану, эндоплазматический ретикулум, митохондрии и пероксисомы и нацеливают SNARE на уникальную целевую мембрану. Считается, что SNARE являются основными необходимыми компонентами механизма слияния и могут функционировать независимо от дополнительных цитозольных вспомогательных белков. Белки SNARE преодолевают энергетический барьер посредством белково-липидных и белково-белковых взаимодействий. Такие SNARE белки отвечают, например, за узнавание везикул с нейромедиаторами и слияние их с пресинаптической мембраной.
У животных существует ряд генов, имеющих изначально вирусное происхождение и работающих в эмбриональном и постнатальном периодах в различных органах. В связи со спецификой своего вирусного происхождения часть этих генов осталась в геноме как сломанные гены — псевдогены. Другая часть — рабочие гены — участвуют в процессах морфогенеза и слияния клеток (рис. 4а–г). Такие эндогенные ретровирусы, например, контролируют активацию генов в зиготе — после оплодотворения яйцеклетки. Благодаря таким вирусным генам появились синцитии в мышцах, остеокластах, хрусталике, плаценте, эмбриональных яичниках и семенниках. Можно сказать, что именно благодаря вирусам возник половой процесс, и именно вирусы способствовали развитию системы внеклеточных везикул для межклеточных взаимодействий. Так, некоторые гены эндогенных ретровирусов участвуют в развитии плаценты, защите хозяина от инфекции экзогенными ретровирусами и в пластичности генома. Белок синцитин-2 (HERV-FRD) является иммунодепрессантом (эта суперспособность как раз свойственна вирусным белкам), его иммуносупрессивный домен защищает плод от иммунной системы матери, а синцитин-1 (HERV-W) может участвовать в образовании плацентарного трофобласта, участвует в слиянии раковых клеток, а также в слиянии остекластов человека.
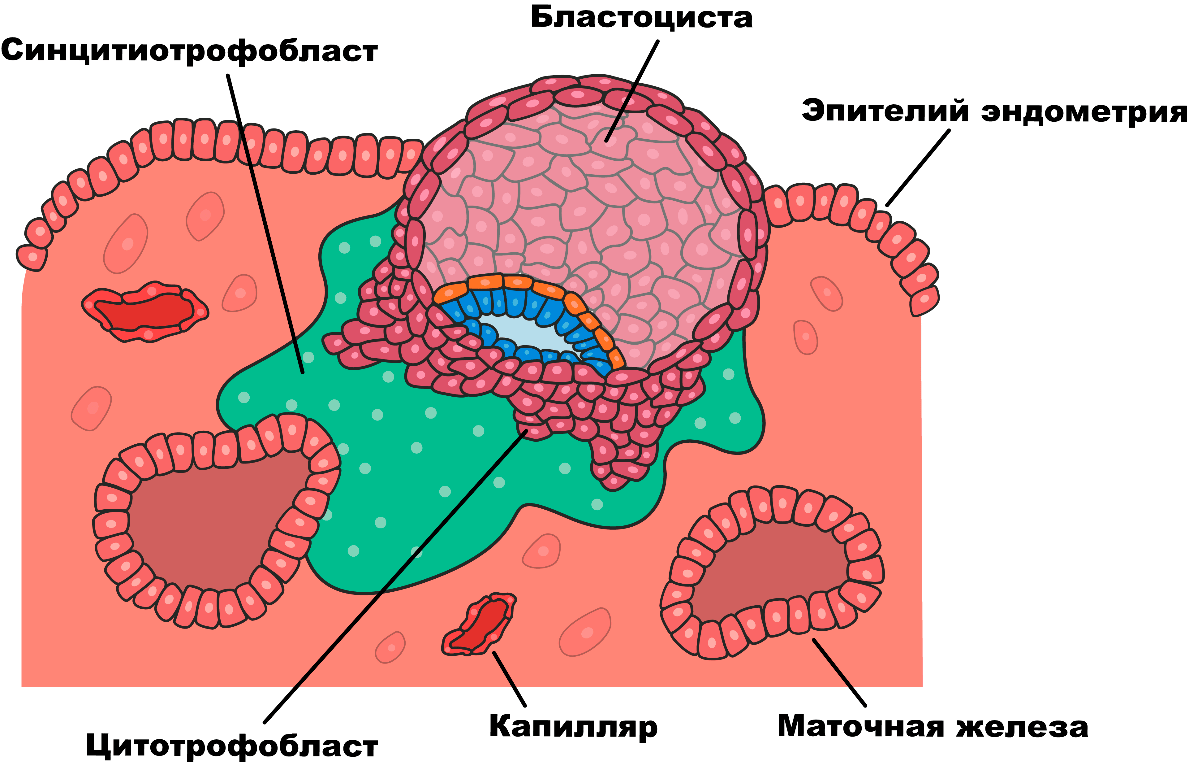
Рисунок 4а. Синцитий в формирующейся плаценте человека. Часть клеток сливается и проникает в слизистую оболочку матки.
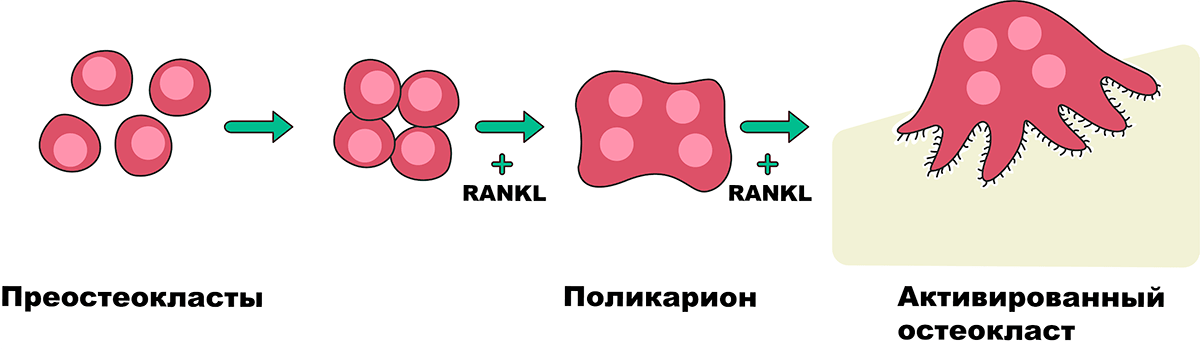
Рисунок 4б. Формирование остеокласта при слиянии клеток-предшественников
Рисунок 4в. Формирование синцития в культуре клеток
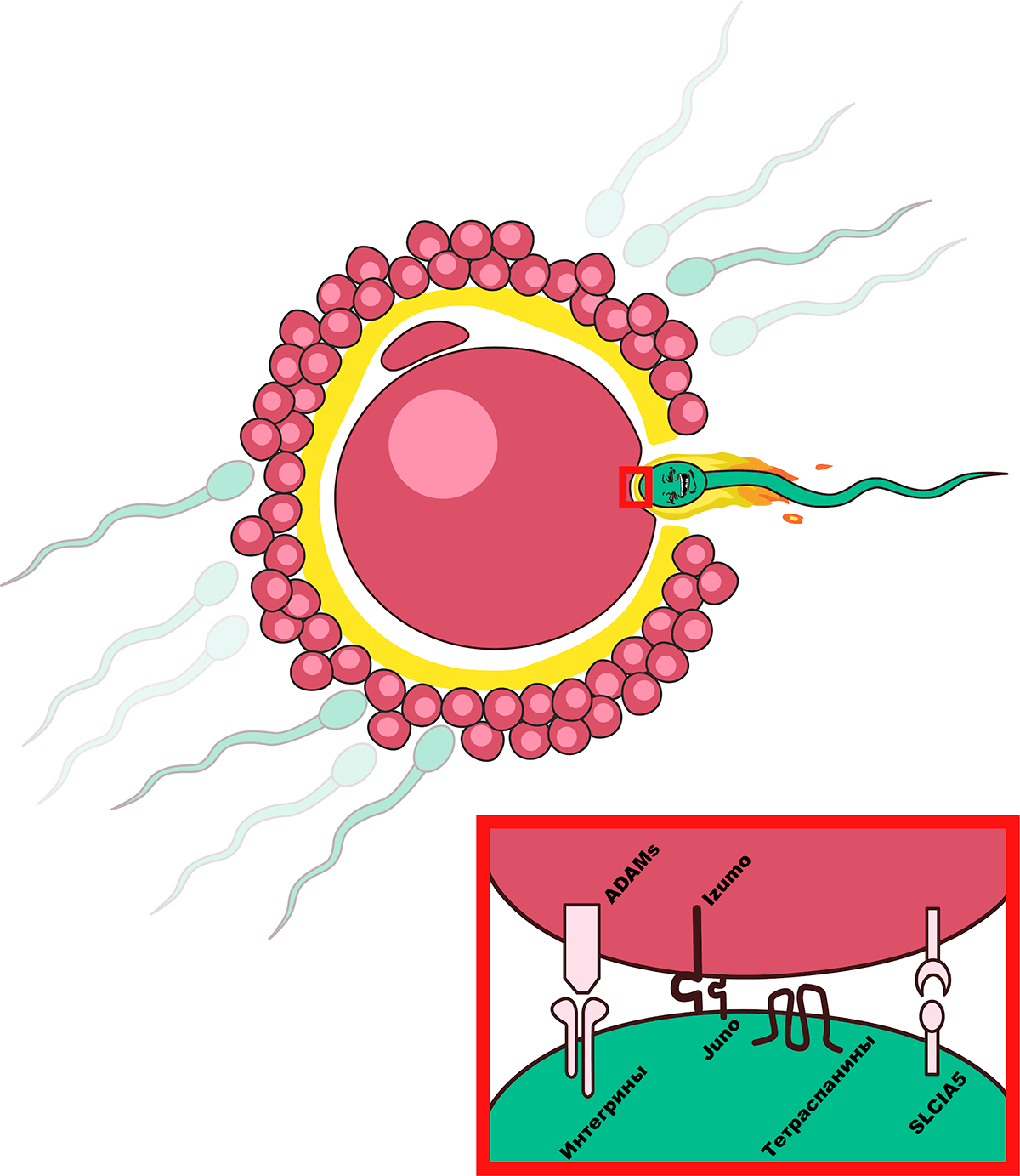
Рисунок 4г. Молекулы, участвующие в слиянии сперматозоидов и мембран ооцитов при оплодотворении
Крайне интересна роль белков слияния в появлении полового процесса. Без них гаметы не смогли бы сливаться, а, учитывая вирусное происхождение этих белков, можно сказать, что без горизонтального переноса вирусных генов, отвечающих за слияние мембран, не было бы полового процесса, и сложные многоклеточные организмы не смогли бы развиться. Лишенные органелл хрусталиковые волокна могут жить только в условиях синцития, где эпителий и молодые, не утратившие ядра, волокна обеспечивают жизнедеятельность глубоких волокон за счет движения веществ в каналах межклеточных щелевидных контактов. Внутри синцития все клетки становятся взаимосвязаны через проницаемый для макромолекул путь, позволяющий крупным молекулам свободно распространяться между соседними клетками. Слияние клеток происходит во время терминальной дифференцировки клеточных волокон в хрусталике позвоночных. В эмбриональном периоде или в ходе регенерации поперечнополосатой мышечной ткани предшественники мышечных клеток сливаются друг с другом, формируя мышечное волокно. Межклеточное распознавание в мышечных клетках обеспечивается белками слияния Duf и Sns и регулируется белками Mbc и Loner. После контакта клеток происходит образование белковых комплексов слияния, электронно-плотных бляшек и разрушение мембран, что регулируется белками Rols, Blow и Kette.
Имеющиеся в организме человека белки, работающие в процессах слияния клеток, участвуют также в межклеточной коммуникации посредством экзосом, например, в плаценте. В то же время органов, которые имеют синцитиальное строение, не так много, что ограничивает применение человеческих белков слияния для адресной доставки препаратов в составе внеклеточных везикул и экзосом. Использование таких конструкций с вирусными белками слияния, имеющими направленность в определенный орган человека (а многие вирусы поражают именно конкретный орган), расширяет диапазон применения систем доставки, основанных на везикулах. Так, например, вирусы различных семейств (Rubella, Mumps, Enterovirus, CMV, EBV, Rotavirus, Adenovirus, Reovirus, Ljungan virus) имеют тропность к эндокринной и/или экзокринной частям поджелудочной железы. Применение такой системы доставки на основе экзосом с вирусными белками слияния повысит специфичность распознавания целевой ткани и эффективность проникновения в нужные клетки.
Автор этой статьи работает в лаборатории регуляции клеточной сигнализации МФТИ и изучает возможность применения вирусных белков слияния (на примере человеческого респираторного синцитиального вируса (ЧРСВ)) для получения системы адресной доставки и обхода эндосомального пути проникновения в клетки. Генетический материал ЧРСВ представлен молекулой РНК, в которой закодирован белок слияния. Он определяет эффективное и целевое слияние с эпителием респираторного тракта. Клонировав ген этого белка и трансформировав культуру клеток in vitro, можно добиться формирования синцития. Такой синцитий выставляет на своей поверхности белки слияния и продуцирует как экзосмы, так и внеклеточные везикулы, содержащие эти белки. В клеточной культуре можно наработать молекулу, которую необходимо транспортировать, или загрузить ее в формирующиеся везикулы/экзосомы извне. Такие экзосомы и внеклеточные везикулы смогут специфически сливаться с целевыми молекулами на респираторном эпителии. Использование белков слияния другой направленности позволит расширить диапазон целей для доставки грузов в нужные ткани и органы.
In vivo и in situ перспективы
Кроме использования экзосом и внеклеточных везикул как систем доставки, ученые пытаются доставлять препараты, используя тромбоциты или тромбоцит-подобные образования (рис. 5). Такие тромбоциты / тромбоцит-подобные образования могут быть получены in vitro в культуре мегакариоцит-подобных клеток. Такая система доставки имеет большую емкость, может сама производить и накапливать в себе ДНК, РНК, белки, иметь на своей поверхности ряд белковых молекул, поочередно активирующихся при проникновении в нужный орган. Такие тромбоцит-подобные клетки могут быть лишены факторов свертывания крови, иметь на своей поверхности рецепторы к эндотелиальным клеткам определенного органа и быть способны пройти через эндотелиальные клетки в целевой орган при взаимодействии с ними. Благодаря остаткам актинового цитоскелета в тромбоцит-подобных клетках сохраняется способность к деформации. В ходе прохождения через эндотелиальные клетки в результате деформации мембраны тромбоцита возможна активация (выворачивание наружу) открытой канальцевой системы — внутренней мембранной структуры тромбоцитов. При наличии белков слияния в мембране внутренней канальцевой системы возможно слияние не с эндотелиальными клетками нужного органа, а непосредственно с клетками органа, в который нужно доставить молекулярный груз. Возможно, когда-нибудь и такая система доставки будет реализована, и мы научимся отправлять нужные молекулы в нужное место и время.
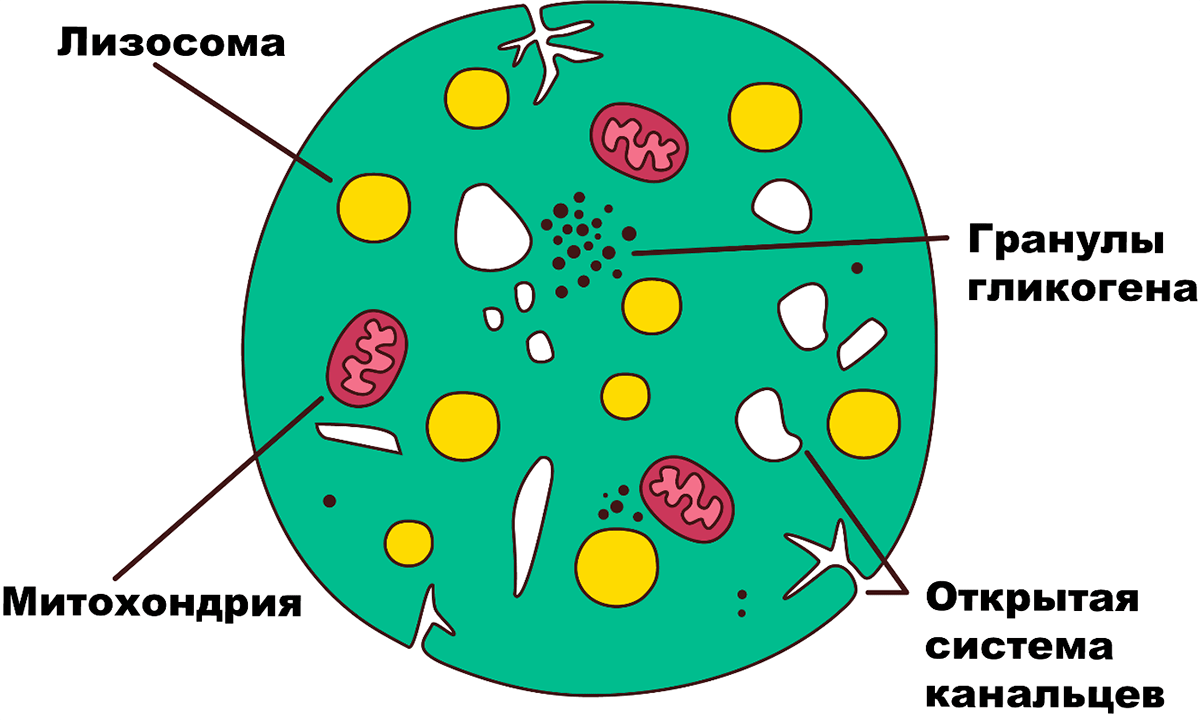
Рисунок 5. Схематическое строение тромбоцита
В заключение стоит еще раз определить области применения адресной системы доставки молекул. «Википедия» дает такое определение лекарственного средства: «Это вещество или смесь веществ синтетического или природного происхождения в виде лекарственной формы (таблетки, капсулы, раствора, мази и т.п.), применяемые для профилактики, диагностики и лечения заболеваний». В то же время использование генетических конструкций для терапии различных патологий является новым направлением и не входит в традиционное представление о применении лекарств. Огромные перспективы открывает технология редактирования генов CRISPR/Cas9. На ее основе ведутся разработки систем лечения ряда вирусных заболеваний, иммунных патологий, различных типов рака и болезни Паркинсона. На сегодняшний день достигнуты значимые успехи в репрограммировании клеток из одного типа в другой. В условиях in vitro возможно менять фенотип клетки, превращая, например, фибробласт в нейрон или мышечную клетку. Однако эффективность репрограмирования клеток или редактирования гена в живом организме пока составляет не более 3%. Какие бы успехи по редактированию генома и репрограммированию клеток не были достигнуты, без адресной системы доставки и эффективного механизма проникновения в клетки их использование ограничено и даже опасно. Изменение генетических последовательностей и программы развития клеток должно производиться в контролируемых условиях только в определенных органах. Различные подходы к эффективной доставке уже выработаны в ходе эволюции теми организмами, жизненный путь которых лежит через организм человека, — вирусами.
Источник: БИОМОЛЕКУЛА

