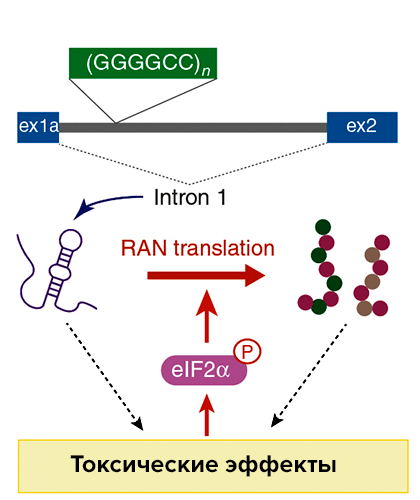
RAN-трансляция в случае синдрома ломкой X-хромосомы / атаксии
Всем нам известно со школы, что трансляция начинается со старт-кодона — кодона AUG. Однако в 2011 году был описан особый вид AUG-независимой трансляции, обычно характерный для генов, содержащих повторы из нескольких нуклеотидов. Очень часто увеличение количества таких повторов приводит к развитию нейродегенеративных заболеваний, например, болезни Хантингтона. Самое удивительное, что кодон AUG для синтеза таких белков с повторяющимися аминокислотами не нужен вовсе: трансляция может начинаться с любой из трех возможных рамок считывания. Этот загадочный вид трансляции получил название «RAN-трансляция» (от англ. repeat associated non-AUG translation). Как же она работает?
Как может проходить инициация трансляции
Трансляция подавляющего большинства мРНК начинается с распознавания особого видоизмененного нуклеотида — метил-7-гуанозина (так называемого кэпа) — на их 5′-конце преинициаторным комплексом, который состоит из малой субъединицы рибосомы (40S) и ряда белков, известных как факторы инициации трансляции. Сев на транскрипт, преинициаторный комплекс начинает «сканировать» его, то есть двигаться к 3′-концу в поисках первого старт-кодона — кодона AUG, расположенного в оптимальном нуклеотидном окружении. Когда старт-кодон найден и связан с преинициаторным комплексом, к комплексу присоединяется большая рибосомная субъединица. Далее все факторы инициации покидают комплекс, и начинается собственно трансляция (рис. 1а).
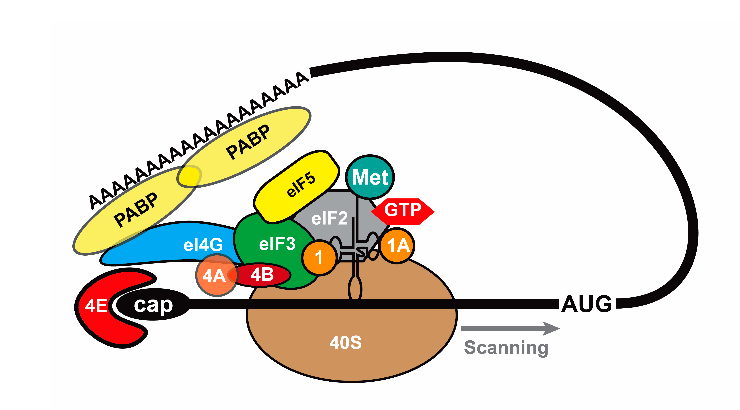
Рисунок 1а. Механизм инициации трансляции. Самый распространенный тип — кэп-инициация.
Некоторые вирусы научились «обманывать» рибосому, заставляя ее транслировать свои РНК, лишенные кэпа, за счет особых структурных элементов на их 5′-конце — IRES (от англ. internal ribosome entry site — внутренний сайт посадки рибосомы). IRES имеют очень сложную пространственную структуру, которая и вводит рибосому в заблуждение (рис. 1б).
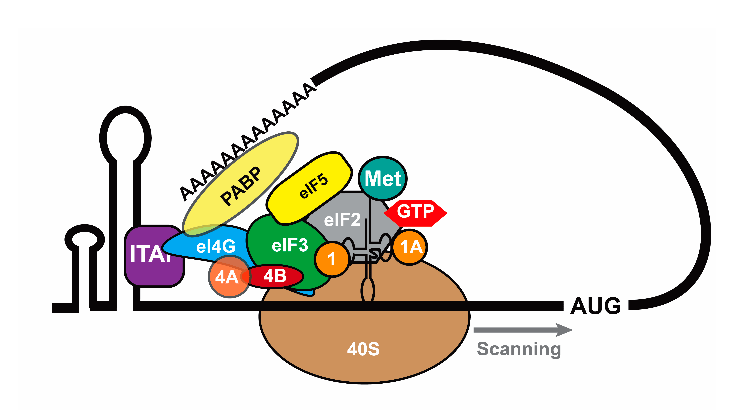
Рисунок 1б. Механизм инициации трансляции. IRES-инициация.
Более сорока нейродегенеративных заболеваний человека связаны с мутациями в ряде генов, которые заключаются в увеличении числа повторов определенных групп нуклеотидов. Пожалуй, наиболее известный пример — болезнь Хантингтона , сопровождающаяся, помимо тяжелейших когнитивных, неврологических и психических нарушений, характерными неконтролируемыми движениями, напоминающими зловещий танец. Этот недуг наследуется аутосомно-доминантно и проявляется, как правило, уже в среднем возрасте, поэтому те, кому суждено им заболеть, зачастую успевают передать болезнь своим детям, сами того не подозревая. Причина болезни Хантингтона кроется в числе повторов CAG в гене, кодирующем белок хантингтин. Когда их число превышает 40, у человека развивается болезнь.
Похожий механизм лежит в основе спиномозжечковой атаксии типа 8, при которой увеличивается число повторов CAG в последовательности гена атаксина 8 (ATXN8). Именно на его примере в 2011 году описали новый механизм AUG-независимой трансляции — RAN-трансляцию. К удивлению ученых, мутация единственного кодона AUG, расположенного перед повторами CAG, не останавливала синтез белка: трансляция продолжалась, причем во всех трех возможных рамках считывания. Получающийся белковый продукт в зависимости от рамки считывания имел аномально длинный полиглутаминовый, полисериновый или полиаланиновый тракт (последовательность аминокислот), естественно, был нефункциональным и образовывал скопления в клетках.
Что же заставляло рибосому начинать синтез белка в отсутствие стандартного старт-кодона? Выяснилось, что рибосома, по-видимому, способна распознавать вторичные структуры, которые формируют повторы CAG, причем чем меньше повторов CAG, тем менее эффективна RAN-трансляция. Удивительно, что RAN-трансляция идет и с антисмыслового транскрипта, содержащего повторы CUG.
С тех пор RAN-трансляцию описали при болезни Хантингтона, некоторых видах бокового амиотрофического склероза и лобно-височной деменции, синдроме ломкой X-хромосомы / атаксии и других нейродегенеративных болезнях. Похоже, в каждом из перечисленных случаев механизм RAN-трансляции уникален, и мы опишем лишь несколько из них.
Синдром ломкой X-хромосомы / атаксия
Синдром ломкой X-хромосомы / атаксия (fragile X-associated tremor/ataxia, FXTAS) — это поздно проявляющееся нейродегенеративное заболевание, связанное с увеличением числа повторов CGG в 5′-нетранслируемой области (5′-UTR) гена FMR1. У здоровых людей число повторов не превышает 45, а у больных может насчитываться до 200 повторов. Любопытно, что если их число превышает 200, то происходит сайленсинг FMR1, что приводит к совершенно другому заболеванию.
Инициация RAN-трансляции в 5′-UTR FMR1 в отсутствие AUG возможна в двух рамках считывания, причем в одном случае синтезируется белок с полиглициновым трактом, а в другом — с полиаланиновым. Исследователям удалось показать, что RAN-трансляция, приводящая к образованию белка с полиглициновым трактом, инициируется в области до повторов, потому что вставка стоп-кодона перед повторам CGG предотвращала синтез аномального белка. И начинаться RAN-трансляция может с нескольких кодонов, расположенных в 5′-UTR и отличающихся от AUG одной позицией. Однако вставка стоп-кодона перед повторами CGG никак не сказывалась на синтезе продукта с полиаланиновым трактом.
Похоже, RAN-трансляция может начинаться и в нетранслируемой области, и в области повторов в зависимости от рамки считывания. Недавние исследования показали, что в случае FMR1 RAN-трансляция кэп-зависима, хотя 5′-UTR этого гена и содержит элемент, похожий на IRES.
Боковой амиотрофический склероз и лобно-височная деменция
Наиболее часто в основе бокового амиотрофического склероза и лобно-височной деменции лежит увеличение количества повторов гексануклеотидов GGGGCC/GGCCCC в локусе C9orf72. У пациентов с такими мутациями накапливаются аномальные белки с дипептидными повторами: глицин—аланиновыми и глицин—аргининовыми, если мутантный белок был синтезирован со смысловой цепи, и глицин—пролиновыми, если RAN-трансляция затронула антисмысловую цепь. Мутантные белки с дипептидными повторами накапливаются по всей центральной нервной системе, причем неоднородно: белки с одинаковыми повторами, как правило, обнаруживают в одной области мозга.
Роль RAN-трансляции в случаях бокового амиотрофического склероза и лобно-височной деменции остается неясной: высказывают предположения, что внутриклеточные скопления белков с дипептидными повторами безопасны, а токсичностью для нервной системы обладают белки с дипептидными повторами, откладывающиеся вне клеток, и RAN-трансляция не является основной причиной развития заболевания.
Почему повторы GGGGCC/GGCCCC стимулируют RAN-трансляцию, известно плохо. Показано, что чем больше повторов GGGGCC/GGCCCC, тем больше белков с дипептидными повторами образуется, то есть количество повторов в гене положительно связано с продуктивностью RAN-трансляции. Однако конкретный механизм RAN-трансляции в этом случае так и остается неизвестным. Повторы GGGGCC находятся в пределах первого интрона локуса C9orf72, поэтому предположили, что токсичные белки могут синтезироваться с уже вырезанного интрона. Впрочем, эксперименты на дрозофиле этот механизм не подтвердили. Теоретически возможно, что интроны с повторами не подвергаются сплайсингу и сохраняются в зрелых мРНК. Действительно, такие дефектные транскрипты удалось идентифицировать in vitro, однако их явно недостаточно для развития болезни. Итак, механизм RAN-трансляции и в этом случае пока неизвестен.
Болезнь Хантингтона
Как мы обсуждали выше, болезнь Хантингтона вызвана увеличением числа копий повтора CAG в гене, кодирующем белок хантингтин (кстати, его функции в здоровом мозге остаются неизвестными). В случае болезни Хантингтона RAN-трансляция затрагивает не всю открытую рамку считывания целиком, а какой-то ее внутренний участок, и результатом такой трансляции является токсичный белок с полиглутаминовым трактом. RAN-трансляция может затрагивать и антисмысловую цепь, в результате чего образуются белки с полилейциновыми и полицистеиновыми трактами. Как и в случае FXTAS, вставка стоп-кодона перед областью повторов не подавляет RAN-трансляцию, дающую начало белкам с полилейциновыми и полицистеиновыми трактами.
Несмотря на медицинское значение, наши представления о механизмах RAN-трансляции очень расплывчаты. Мы знаем, что продукты RAN-трансляции — как правило, токсичные белки, содержащие повторы определенных аминокислот. RAN-трансляция может затрагивать как смысловую, так и антисмысловую цепи, а ее эффективность зависит от копийности повторов и нуклеотидного контекста, в котором они расположены. Однако мы ничего не можем сказать о том, как именно происходит инициация при RAN-трансляции. Поскольку воздействие на RAN-трансляцию может иметь высокий терапевтический потенциал для пациентов с нейродегенеративными заболеваниями, будем надеяться, что новые исследования прольют свет на детали этого загадочного пути трансляции.
Источник: БИОМОЛЕКУЛА

