Поскольку взрослый организм происходит от одной-единственной клетки, для каждой его клеточки можно составить «родословную»: проследить, из клетки какого типа она развилась и какие клетки могут «родиться» от нее.
Наш организм состоит из более чем двухсот различных типов клеток. Эти 1013 маленьких живых объектов связаны сложными сетями взаимодействий, причем каждая клетка выполняет свою строго определенную функцию во благо всего организма. За разнообразие клеточного состава и обновление изношенных клеток отвечают стволовые клетки (СК). Они бывают разными и отличаются в первую очередь способностью дифференцироваться — «превращаться» в специализированные клетки. Плюрипотентная СК может дать начало всем клеткам, присутствующим во взрослом организме; СК крови может дать все возможные типы клеток крови (но не нейрон или клетку эпителия кишечника), а потомки клетки — предшественницы кератиноцитов могут быть только кератиноцитами (такая клетка называется унипотентной).
Стволовые клетки взрослого организма
Стволовые клетки (СК) находятся в организме в строго определенных местах, которые, благодаря окружающим клеткам и внеклеточному матриксу, обеспечивают правильное функционирование стволовых клеток. Такие места называются клеточной нишей. В костном мозге есть два типа СК: кроветворные, способные дифференцироваться во все клетки крови, и мезенхимные (МСК), дающие начало костной, хрящевой и жировой тканям и составляющие важную часть стромы кроветворения (ниши кроветворной СК), но ни при каких обстоятельствах не способные дифференцироваться в клетки крови.
Самые первые — стволовые клетки крови
Первыми СК взрослого организма, с которыми познакомилась наука, стали, пожалуй, стволовые клетки крови. Еще в 1903 году русский ученый А.А. Максимов, наблюдая за поведением клеток крови, ввел понятие «стволовая клетка». Иерархия клеток-предшественниц в кроветворной системе представлена несколькими отделами, которые были определены физиологическими методами. Кроветворные клетки лабораторных мышей уничтожали радиацией, затем облученным животным подсаживали клетки, «стволовость» которых требовалось изучить. Оказалось, что в костном мозге есть стволовые клетки, способные к мультипотентной дифференцировке во все линии кроветворных клеток и к активному и многократному делению. В их силах полностью восстановить кроветворение в облученном организме. На этом свойстве СК крови основан успех пересадки костного мозга пациентам после лучевой терапии лейкозов.
Ниже в иерархии стоят олигопотентные клетки-предшественницы — родоначальницы только нескольких линий клеток крови, таких как общие миелоидные предшественники (дающие моноциты, мегакариоциты, эритроциты) и общие лимфоидные предшественники (дающие В-, Т- и НК-клетки ).
Еще более низкую ступень в иерархии занимает отдел уни- и бипотентных клеток-предшественниц, способных дифференцироваться только в одном или двух направлениях.
Самые популярные — мезенхимные стволовые клетки
Если стволовые клетки крови интенсивно изучают уже более 100 лет, то активные исследования МСК начались лишь в последней четверти ХХ века. Особенно интересен их потенциал для клеточной терапии, поскольку они содержатся в костном мозге, взятие образца которого не очень травматично для человека. МСК активно делятся в чашке Петри, и их можно «подтолкнуть» к дифференцировке в костную, хрящевую и жировую ткани.
Большой медицинский потенциал сподвиг Бигильдеева А.Е. с соавторами досконально изучить этот тип клеток при помощи генетического штрихкодирования клеточных популяций. При извлечении МСК из костного мозга в каждую клетку вносят метку — небольшой уникальный фрагмент ДНК, который встраивается в геном клетки и потому будет находиться в геномах всех ее потомков. Анализ этих меток после роста в чашке Петри позволяет определить, потомки каких клеток размножились сильнее, а каких — не оставили потомков.
Оказалось, что популяция МСК гетерогенна и представлена множеством клеточных клонов (потомков одной исходной клетки), различающихся по способности к делению и дифференцировке. При многократном пересеве культуры ее клональный состав значительно меняется из-за ухода потомков клеток, не способных к долгому размножению. МСК с высокой способностью к размножению чаще выявляются на ранних этапах культивирования вне организма, и в поликлональной популяции МСК содержится лишь небольшое количество таких клеток. В связи с этим в подходах регенеративной медицины, требующих активного размножения клеток, рекомендуется применять МСК ранних пассажей (то есть те, что жили в чашке Петри недолго). Благодаря подобным исследованиям становится ясно, что хранить в замороженном виде МСК в больших количествах невозможно: для этого придется их долго культивировать, и они могут утратить требуемые стволовые свойства. Тут можно обратиться к более ранним стволовым клеткам, каких во взрослом организме уже не остается.
Эмбриональные стволовые клетки
Некоторые стволовые клетки функционируют не просто в особом месте организма, но и в строго определенное время. Тотипотентностью — способностью дифференцироваться во все клетки организма и экстраэмбриональные ткани — обладает только зигота, но уже после нескольких делений это свойство утрачивается навсегда. На стадии бластоцисты происходит первая специализация клеток эмбриона: выделяются клетки трофобласта (наружный слой, который затем образует экстраэмбриональные ткани) и клетки внутренней клеточной массы, из которых разовьется весь организм (рис. 1). Последние при культивировании в чашке Петри называются эмбриональными стволовыми клетками (ЭСК). Впервые удалось вывести этот тип клеток в культуру в 1981 году. Добавляя в культуральную среду определенные белки — факторы роста, — удается долго поддерживать ЭСК в недифференцированном плюрипотентном состоянии. ЭСК активно размножаются, сохраняя при этом свои свойства, что позволяет получать большое количество клеток для исследовательских задач и для применения в медицине.
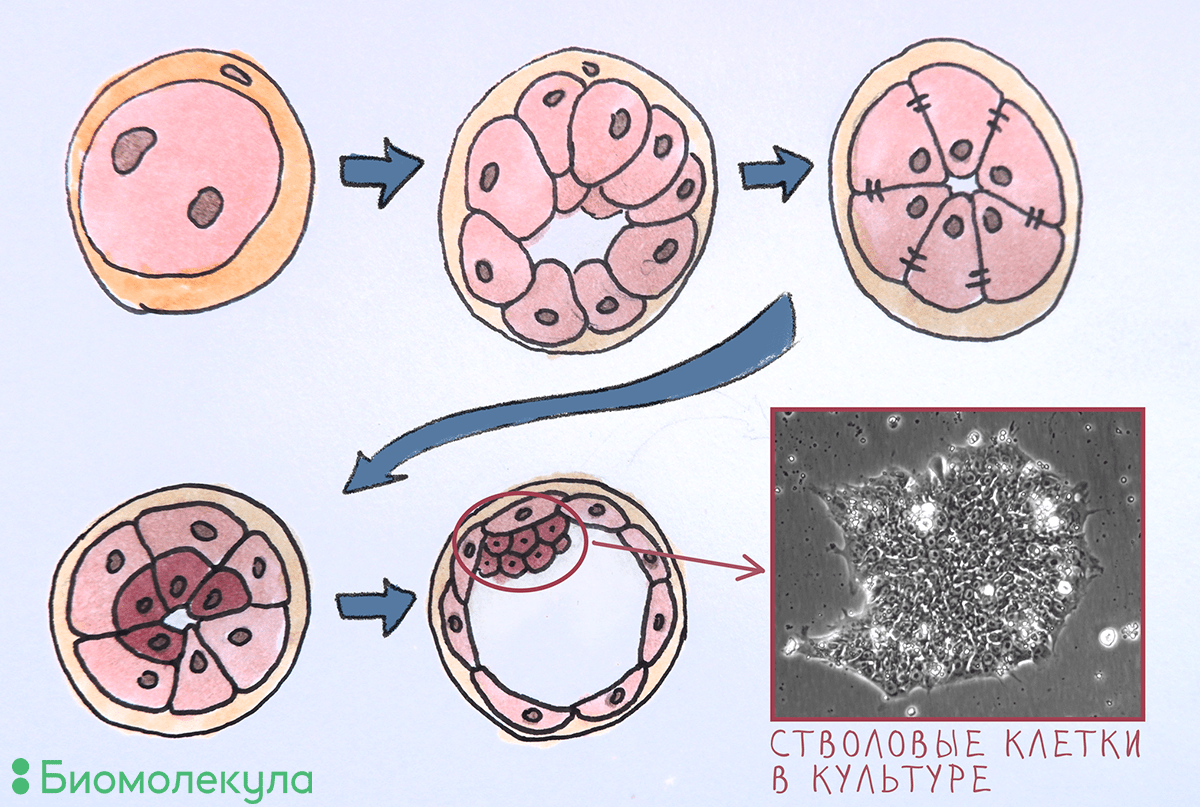
Рисунок 1. Первые пять дней развития эмбриона человека. 1 — Оплодотворение; 2 — деление (дочерние клетки называются бластомерами); 3 — компактизация (образование плотных контактов между бластомерами); 4 — дифференцировка на внутренний и внешний слои; 5 — образование полости (бластоцеля), внешнего слоя клеток (трофобласта) и внутренней клеточной массы, которую можно извлечь для культивирования в чашке Петри и получить таким образом ЭСК.
Однако, несмотря на свои уникальные свойства, ЭСК не лишены недостатков. А поскольку для получения ЭСК приходится разрушать эмбрион, возникли и этические вопросы. Часть общества негативно настроена по отношению к применению ЭСК в медицине и науке, даже несмотря на то, что донорами ЭСК служат эмбрионы, оставшиеся невостребованными при процедуре экстракорпорального оплодотворения, и существует технология забора единичных клеток, применяемая, например, для ранней эмбриональной диагностики и не вызывающая гибели эмбриона. В 2017 году в России вступил в силу федеральный закон № 180-ФЗ «О биомедицинских клеточных продуктах», регулирующий использование стволовых клеток человека в медицине. Он запрещает использовать для производства биомедицинских клеточных продуктов биоматериал, полученный из эмбрионов или плодов человека. Запрещаются искусственное создание эмбриона человека, прерывание или нарушение процесса развития эмбриона или плода человека в целях производства биомедицинских клеточных продуктов. Поэтому исследователи и бизнес вынуждены фокусироваться на разработке продуктов из постнатальных клеток, то есть взятых уже после рождения.
ИПСК — «искусственные» плюрипотентные стволовые клетки
Один из многообещающих источников стволовых клеток, позволяющий избежать упомянутых этических проблем, — индуцированные плюрипотентные стволовые клетки (ИПСК). За открытие технологии их получения Синья Яманака и Джон Гёрдон в 2012 году были удостоены Нобелевской премии по физиологии или медицине. ЭСК и ИПСК практически неотличимы друг от друга, но явное преимущество ИПСК перед ЭСК состоит в том, что для их получения не нужно разрушать эмбрион. Необходимо просто добыть из взрослого организма материал, забор которого не причиняет человеку вреда: фибробласты кожи, волосяные луковицы, кровь. Чаще всего используют фибробласты из нижнего слоя кожи, вырабатывающие коллаген и эластин и первыми спешащие на помощь при заживлении раны. Их преимущество в том, что они хорошо (и дешево!) размножаются в культуре, а протоколы «репрограммирования» — методы возвращения клетки взрослого организма в плюрипотентное состояние — отлажены и широко доступны. Извлеченные клетки размножают в культуре и разными способами перепрограммируют. Затем, после тщательной характеристики, подтверждающей, что клетки стали плюрипотентными и не содержат хромосомных аномалий, приступают к экспериментам.
Существуют разные протоколы перепрограммирования — как со вставкой ДНК прямо в геном клетки (подходят только для исследовательских целей), так и не оставляющие следов в геноме (подходят и для медицинского применения ИПСК). Получение ИПСК с помощью доставки репрограммирующих факторов в вирусных векторах (например, лентивирусных, относящихся к тому же семейству вирусов, что и ВИЧ), которые встраиваются в геном клетки, широко распространено в лабораторной практике ввиду высокой эффективности, методологической простоты и дешевизны.
Однако клетки, несущие в своем геноме вирусные вставки, потенциально опасны из-за возможности активации протоонкогенов в организме пациента — прямого пути к развитию злокачественных заболеваний. Чтобы сделать ИПСК безопасными для медицины, предстояло преодолеть проблемы геномной интеграции и неполного «замолкания» трансгенных факторов репрограммирования, возникающие при использовании вирусных систем. Появились протоколы перепрограммирования, не требующие изменения генома. Среди таких методов можно отметить применение синтетических РНК факторов репрограммирования или же самих этих факторов, в белковой форме. Доставленные в клетку, эти молекулы начинают работать так, будто бы клетка сама их синтезировала. Однако широкому распространению этих методов препятствует то, что синтез и очистка РНК и белков в пробирке стόят очень дорого, а эффективность репрограммирования готовыми белками очень низка: в ИПСК превращаются лишь 0,006% обработанных клеток.
Решение, как это часто бывает в науке и технике, удалось подсмотреть у природы. С одной стороны, никакая искусственная система доставки биологических молекул в клетку не будет так эффективна, как вирус, поскольку он миллионы лет эволюции оттачивал мастерство заражения клетки. С другой стороны, кроме упомянутых выше, существуют вирусы с совершенно другим жизненным циклом, в ходе которого вирусный генетический материал не встраивается в геном клетки-хозяина, — а это именно то, что нужно для безопасных медицинских манипуляций. Производство таких вирусных векторов тоже не дешевое «удовольствие», но это неудобство с лихвой окупается высокой эффективностью перепрограммирования — до 1% (да, для репрограммирования клеток это действительно много!). Получаемые таким методом ИПСК безопасны для клинического использования, поскольку геном клетки не меняется (а значит, и не повреждается), и никакие опасные трансгены в организме пациента активироваться не могут.
Впрочем, каким бы способом мы ни получали ИПСК, лишь в редких случаях можно работать непосредственно с плюрипотентными клетками. При изучении заболеваний «в пробирке» целесообразнее всего анализировать именно тот тип клеток, который повреждается при этой болезни. Для клинической практики плюрипотентные клетки не подходят категорически, поскольку в организме они могут превратиться много во что, в том числе и в опухоль (тератому). Необходимо трансплантировать именно тот тип клеток, который нуждается в замене или восполнении, и современные клеточные технологии позволяют сделать это в условиях лаборатории.
Дифференцировка плюрипотентных клеток «в пробирке»
Изучать «молекулярные детали» большинства заболеваний прямо на пациентах неудобно (или даже невозможно): например, если болезни подвержены мозг или сердце, образцы поврежденных тканей можно получить только после смерти пациента. Зачастую к моменту ухода пациента из жизни ткани и органы повреждены болезнью настолько, что в них не остается интересующих исследователя клеток. В мозге страдавших болезнями Альцгеймера или Паркинсона на месте пораженных структур остаются только пустоты, и говорить об изучении причин гибели нейронов уже не приходится. Вот почему исследователям необходимы адекватные модели различных заболеваний.
Разработку и проверку новых лекарств на стадии доклинических исследований ведут на модельных животных, и это порождает массу ограничений, так как многие вещества метаболизируются у таких животных и человека по-разному. Лабораторные животные не страдают многими заболеваниями — той же болезнью Паркинсона, например. В таком случае поражение специфического типа нервных клеток вызывают химическими веществами или усиленной работой мутантного гена, с которым связывают развитие болезни. Модель, основанная на таком «искусственном» развитии болезни у лабораторного животного, не всегда адекватно воспроизводит симптомы заболевания, а это затрудняет его изучение.
С одной стороны, проблема решается прочно укоренившейся в мире практикой клинических исследований, доказывающих эффективность и оправданность применения разрабатываемых лекарств на людях. С другой стороны, заметно помочь в разработке препаратов могут модели заболеваний на основе ИПСК, несущих связанные с развитием той или иной болезни мутации, из клеточного материала пациентов с установленным диагнозом. ИПСК представляют собой практически бесконечный источник клеточного материала и могут превращаться в любой тип клеток взрослого организма, в том числе в предшественников нейронов, зрелые нейроны и кардиомиоциты. Разработка таких моделей наследственных заболеваний позволит изучать функции продуктов мутантных генов в клетке и механизмы развития патологии. Дифференцированные производные ИПСК можно использовать для скрининга новых лекарственных препаратов (рис. 2).
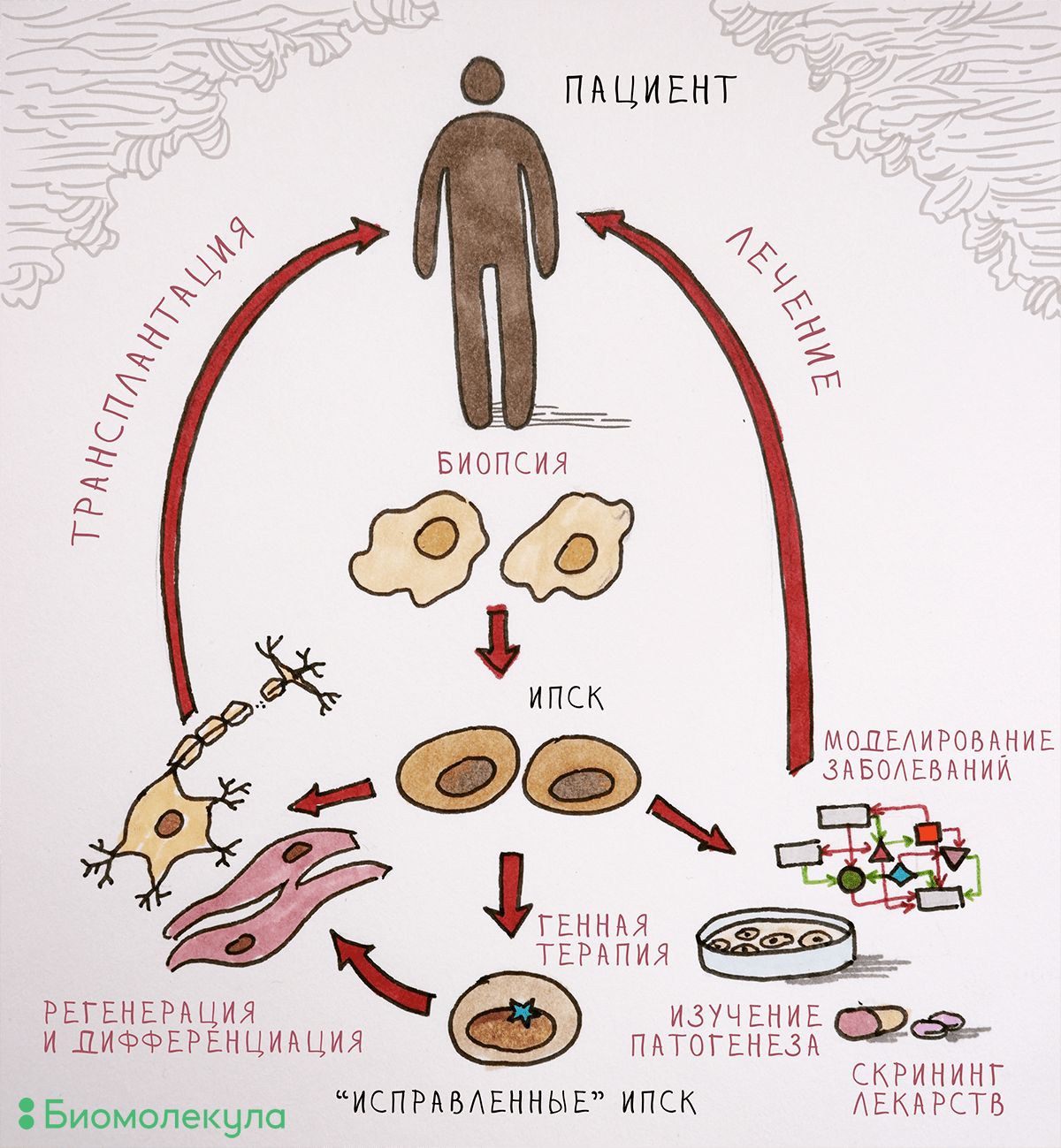
Рисунок 2. Применение ИПСК в биологии и медицине. Полученные из клеточного материала взрослого человека ИПСК можно «превратить» в любой тип клеток. Дифференцированных потомков этих СК можно оставить в лаборатории, чтобы изучать механизмы развития болезни и проверять новые лекарственные средства, а можно и трансплантировать пациентам (разумеется, подтвердив безопасность протоколов лечения).
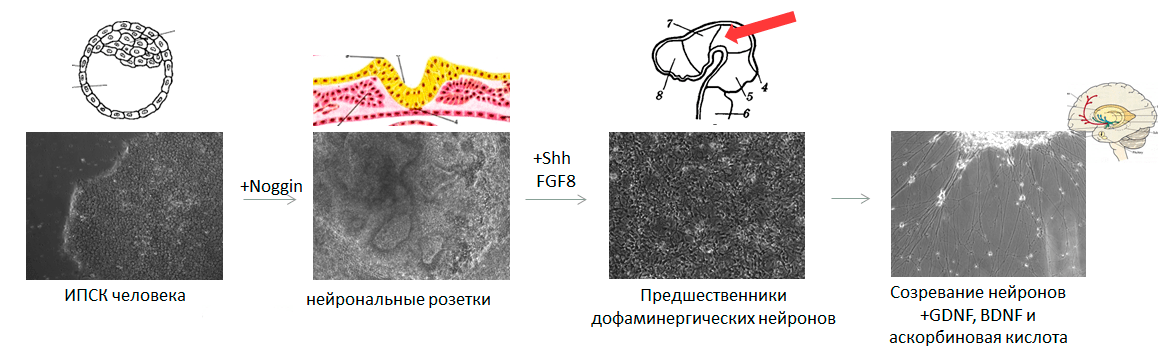
Для создания модели заболевания на основе ИПСК необходимо превратить их в тот тип клеток, который повреждается при изучаемой патологии. Наиболее востребованы модели нейродегенеративных и кардиологических заболеваний, ведь в этих случаях поврежденные ткани напрямую не доступны исследователям. Для запуска дифференцировки в нужную сторону необходимо воспроизвести в чашке Петри те же условия, с которыми клетка сталкивается в организме. Рассмотрим, как можно получить клетки нервной системы — нейроны, производящие дофамин (а именно они погибают при болезни Паркинсона).
Дифференцировка в клетки нервной системы: трудно, долго, красиво
Тут мы должны слегка углубиться в эмбриологию, ведь нужно будет имитировать все изменения в окружении клетки, происходящие от стадии бластоцисты до формирования головного мозга. Придется учитывать и механические воздействия на клетку, и своевременное появление определенных белков — факторов дифференцировки, — и их концентрацию, и состав солей в окружающей клетку среде, и особенности поверхности, к которой клетка прикреплена.
Перед запуском ИПСК в дифференцировку важно убедиться, что клетки растут в оптимальной плотности: они должны занимать почти всю площадь чашки Петри. Это необходимо, чтобы на старте превращения клетки давили друг на друга ровно так, как это происходит на первом этапе формирования нервной системы эмбриона — при развитии нервной трубки. Клетки, которые находятся на дне нервной бороздки, испытывают давление из-за активного размножения соседних клеток и изгибания самой бороздки в трубку, а клетки, расположенные сверху, наоборот, испытывают растяжение и превращаются в нервный гребень. Из нервного гребня впоследствии развивается множество типов клеток, в том числе и волосяные луковицы, а из клеток, находящихся на дне нервной бороздки, образуется центральная нервная система (рис. 3).

Рисунок 3. Последовательные стадии развития нервной системы (ранние этапы). Первоначально будущие клетки нервной системы изменяют форму и характерным образом располагаются друг относительно друга — получается нервная пластинка. Затем она изгибается, превращаясь в нервную бороздку, где на клетки действуют механические силы. Наконец, нервная бороздка замыкается в нервную трубку. Красные стрелки показывают механические силы, действующие на клетки. Нейрональные розетки — аналог нервной трубки в чашке Петри. Увеличение 100×.
Для дифференцировки в нейроны помимо механических сил необходимо воздействие специальных факторов — в основном, белка Noggin (на английском сленге означает «башка»). Он ингибирует сигнальные пути, ведущие к формированию мезодермы, обеспечивая таким образом нейрализацию (образование нервной трубки) эктодермы над местом закладки хорды. Добавляя в чашку Петри к ЭСК или ИПСК рекомбинантный белок Noggin, можно получить чистую популяцию ранних нейронных предшественников, аналогичных клеткам нервной трубки.
В процессе развития нервной трубки происходит ряд событий, ведущих к усложнению ее пространственной организации и клеточного состава. После замыкания нервной трубки начинается активное деление ее клеток, приводящее к многослойности трубки. Одновременно с разрастанием и утолщением нервной трубки происходит ее изгибание, необходимое для «укладки» формирующегося мозга в черепной коробке. За специализацию дофаминергических нейронов черной субстанции среднего мозга отвечают белок Sonic hedgehog (да-да, он назван в честь ёжика Соника) и фактор роста фибробластов 8 (FGF8).
Здесь важно правильно выбрать последовательность и количество белковых факторов, добавляемых в питательную среду дифференцирующимся клеткам (рис. 4). Если на ранних этапах развития нервная система представляла собой просто трубку, то теперь мозг приобретает сложную трехмерную организацию. Решающую роль в этом процессе играют градиенты факторов дифференцировки: выделяясь в определенных участках мозга, эти факторы диффундируют в окружающие ткани, и чем дальше от «места производства», тем их концентрация ниже. Сигналом к формированию определенного типа нейронов служит не сам по себе фактор дифференцировки, а его концентрация. Например, если добавить в среду с дифференцирующимися клетками меньше Sonic hedgehog, то вместо нейронов, вырабатывающих дофамин, мы получим нейроны, производящие гамма-аминомасляную кислоту, относящиеся к совершенно другой структуре мозга и выполняющие другие функции.
Рисунок 4. Параллель между нейрогенезом эмбриона и тем, как это выглядит в чашке Петри. Отправная точка — ЭСК или ИПСК (аналогичны внутренней клеточной массе бластоцисты). Под воздействием белкового фактора Noggin плюрипотентные клетки дифференцируются в ранние нейронные предшественники, аналогичные клеткам нервной трубки. Затем под действием более специфических факторов дифференцировки образуются специализированные нейронные предшественники, соответствующие конкретному отделу развивающегося мозга. И на последнем этапе при внесении белков GDNF и BDNF нейроны «созревают», становясь аналогичными клеткам полностью сформированного мозга.
На последнем этапе дифференцировки клетки культивируют в присутствии нейротрофных факторов BDNF и GDNF , которые способствуют созреванию нейронов (рис. 5). Это очень важная стадия дифференцировки: хотя судьба клеток (их «профессия») уже определена, но без прохождения этого этапа клетки так и останутся специализированными нейронными предшественниками. На данном этапе клетки «взрослеют», то есть перестают размножаться, образуют длинный отросток, начинают выделять нейромедиатор, формировать между собой сеть взаимодействий и проводить электрические импульсы — иначе говоря, начинают выполнять те функции, для которых и предназначены во взрослом мозге.
Поскольку при нейродегенеративных заболеваниях, в том числе и при болезни Паркинсона, гибнут именно зрелые нейроны у взрослых людей, а не их размножающиеся предшественники, для моделирования болезни правильно брать как раз зрелые нейроны, чтобы с большей достоверностью повторить развитие патологических процессов. С другой стороны, можно изучать особенности дифференцировки нейронов и выяснять, что и как на эту дифференцировку влияет. Аналогичные подходы можно применить при получении кардиомиоцитов — клеток сердца, изучать которые прямо в организме тоже непросто.
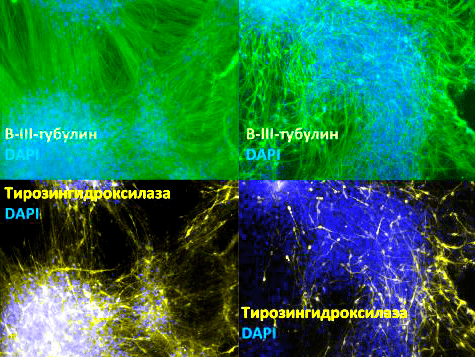
Рисунок 5. Зрелые нейроны, полученные путем дифференцировки из клеток-предшественниц. Различные структуры нейронов флуоресцентно окрашены: бета-III-тубулин (присутствует во всех типах нейронов; окрашен зелёным), тирозингидроксилаза (фермент, участвующий в синтезе дофамина; характерен для нейронов, выделяющих дофамин; окрашен желто-зеленым), ядра клеток (окрашены синим). Увеличение 100×.
Дифференцировка в клетки сердца
Получение ИПСК от пациента и их последующая направленная дифференцировка в кардиомиоциты открывают новые возможности для изучения патогенеза наследственных сердечно-сосудистых заболеваний, в частности гипертрофической кардиомиопатии, от которой до сих пор не разработано эффективного лечения. При этом заболевании утолщаются стенки левого желудочка и межжелудочковой перегородки, развиваются сердечная недостаточность и аритмия, возрастает риск внезапной сердечной смерти. Гипертрофическая кардиомиопатия — одна из самых распространенных сердечно-сосудистых патологий: 1 случай на 500 человек. Елена Дементьева с коллегами создала модель этого заболевания на основе пациентспецифичных ИПСК. Исследовав геном пациента с гипертрофической кардиомиопатией, коллектив обнаружил мутацию R326Q в гене MYBPC3, кодирующем миозин-связывающий белок С. Этот белок расположен в саркомере и играет важную роль в сокращении кардиомиоцита. ИПСК пациента и здорового донора (в качестве контроля) превратили в клетки сердца, которые воспроизводили такие признаки гипертрофической кардиомиопатии, как нарушение динамики потоков ионов кальция и их повышенное внутриклеточное содержание.
Таким образом, описанная клеточная модель для изучения гипертрофической кардиомиопатии представляет собой кардиомиоциты, полученные в результате направленной дифференцировки ИПСК пациента с этой болезнью.
3D-дифференцировка: миниорганы в пробирке
Исследования последних лет, связанные с созданием 3D-органоидов (Еремеев А.В. с соавторами) из ЭСК или ИПСК, существенно облегчили исследования в области моделирования органогенеза человека in vitro и стали мощным инструментом для исследования механизмов развития патологий сложных органов, равно как и разработки новых подходов к их терапии. В последние годы были созданы многоклеточные органоиды мозга человека, толстой кишки, почек, сетчатки, печени. Разумеется, пока 3D-модели многоклеточных органов на основе 2D-культур имеют свои ограничения и лишь условно имитируют их сложную архитектонику.
Тем не менее органоиды всё активнее используют в биомедицине. С помощью органоидов на основе ИПСК уже изучают механизмы наследственных заболеваний мозга (например, микроцефалии), а на органоидах мозга и кишечника проводят тестирование кандидатных лекарственных препаратов для лечения муковисцидоза и лихорадки Зика. Сейчас исследователи получают органоиды из нескольких типов клеток головного мозга или же клеток определенных зон. Добавление соответствующих факторов морфогенеза позволяет получать органоиды различных региональных подтипов мозга: коры головного мозга, мозжечка, среднего мозга, переднего мозга, гипоталамуса, гиппокампа. Есть основания полагать, что клетки в органоидах больше похожи на клетки в организме, чем плоские 2D-культуры на чашке Петри, поскольку они развиваются и образуют связи между собой более «правильно».
Применение плюрипотентных стволовых клеток в медицине
Еще в прошлом веке предпринимались попытки лечения тяжелых заболеваний с помощью клеточной терапии, то есть трансплантации новых, здоровых клеток на место гибнущих от болезни. Так, в 1987 году в Университете Лунда в Швеции провели ряд операций по подсадке в мозг пациентов с болезнью Паркинсона предшественников нейронов, полученных из эмбриона человека. У некоторых пациентов наступили значительные улучшения. Пересаженные клетки выживали в мозге пациентов и довольно долго нормально функционировали. Тем не менее улучшение наблюдалось далеко не во всех случаях, а иногда развивались и осложнения: пересаженные клетки «заболевали» болезнью Паркинсона.
Для решения проблем, выявленных в предыдущей серии трансплантаций, запустили TRANSEURO — клиническое исследование в Европе, в ходе которого в 2014–2016 годах 11 пациентам трансплантировали предшественников нейронов, вырабатывающих дофамин. Однако из-за источника клеток — эмбрионов человека — возникли как этические, так и чисто технические трудности, связанные с получением фетального материала и невозможностью его стандартизации для клинического применения. Из-за сбоев в поставке ткани для трансплантации из 90 запланированных операций по подсадке таких клеток осуществили только 20, и на данный момент проект остановлен. Для того чтобы обойти эти сложности, активно разрабатывают эффективные методы дифференцировки ЭСК и ИПСК для дальнейшего их применения в клинической практике.
Для клинического применения клеточной терапии с использованием ЭСК/ИПСК важно избежать иммунной реакции «трансплантат против хозяина». Технология ИПСК теоретически позволяет исключить или значительно снизить реакцию иммунной системы благодаря использованию собственных линий ИПСК. Однако на практике получение ИПСК и их дальнейшая дифференцировка для каждого пациента всё еще слишком дороги и длительны.
В качестве альтернативы Киотский университет запустил проект Stock, нацеленный на создание банка разных линий ИПСК, типированных по иммунологическим параметрам совместимости (как это делается при пересадке органов). Было подсчитано, что 50 линий ИПСК, специально отобранных по этому принципу, позволят охватить 73% населения Японии. Но не стόит забывать, что развитию иммунного ответа могут способствовать и клетки врожденной иммунной системы, такие как макрофаги и естественные киллеры.
Первые клинические испытания клеточного продукта, полученного из ИПСК, провели в Японии в 2017 году. Тестирование клеток пигментного эпителия сетчатки глаза, дифференцированного из ИПСК, показало, что получать производные ИПСК для каждого конкретного пациента, увы, нерентабельно. Получение клеточного продукта очень трудоемко, дорого и требует жесткого контроля качества каждой созданной клеточной линии — будь то ИПСК или дифференцированные клетки. Поэтому научная общественность склоняется к применению в клеточной терапии «иммунологически совместимых» производных ЭСК и ИПСК. Такие клеточные продукты хоть и не позволят полностью избежать иммунного ответа, но смогут его снизить до уровня, с которым справится более мягкая иммуносупрессивная терапия.
Клинические испытания клеточной терапии болезни Паркинсона с помощью производящих дофамин нейронов, дифференцированных из ИПСК, планируется начать в Киотском университете и в Королевском госпитале Мельбурна. Этому решению предшествовали годы экспериментов на животных моделях. В серии экспериментов на приматах, стартовавшей еще в 2005 году, удалось подобрать оптимальный протокол операции: какое количество клеток нужно ввести в мозг животного, на какой стадии дифференцировки подсаживать клетки, чтобы они оставались в живых и наилучшим образом «встраивались» в поврежденные участки мозга и оказывали терапевтический эффект.
В связи с дороговизной и трудоемкостью получения линий ИПСК для каждого конкретного пациента, взоры практиков сейчас обращены к проектам, подобным Stock. Чтобы еще больше упростить и удешевить клеточную терапию, исследователи хотят прибегнуть к «обману» иммунной системы и получить одну универсальную линию ИПСК, которая бы подходила любому пациенту. Для этого можно генетическими методами убрать с поверхности клетки молекулы HLA I класса — метку «свой—чужой» для иммунной системы: именно различия в этой молекуле между индивидами приводят к реакции «хозяин против трансплантата». Если HLA I класса на поверхности нет, клетки становятся «невидимыми» для большинства иммуноцитов. Но небольшая их часть (естественные киллеры), наоборот, начинает распознавать такие клетки как опасные, поскольку специализируются на определении объектов без сигнала «свой». Однако и их можно обвести вокруг пальца, над чем сейчас и трудятся во многих лабораториях.
Клеточная терапия с использованием стволовых клеток различного происхождения набирает обороты в мировой практике. Такой подход клеточной терапии, как пересадка костного мозга, уже давно прижился в клинической практике. Терапия МСК не всегда дает хорошие результаты. Однако в случае реэпителизации поврежденных кожных покровов (например, при синдроме диабетической стопы) эффективность применения МСК уже показана в клинических исследованиях.
В клинику готовы войти и производные плюрипотентных стволовых клеток (ЭСК и ИПСК). Полученные из ЭСК олигодендроциты и клетки поджелудочной железы, производящие инсулин, находятся на финальных этапах клинических испытаний. В случае олигодендроцитов был заявлен 15-летний срок наблюдения за пациентами после подсадки клеток в спинной мозг. Этот срок еще не истек, но негативных последствий для пациентов до сих пор не обнаружено. Начались клинические исследования клеточных продуктов для терапии таких сложных и тяжелых заболеваний, как дистрофия сетчатки и болезнь Паркинсона. Многие исследования направлены на то, чтобы уменьшить или полностью исключить иммуносупрессию при пересадке дифференцированных производных ЭСК и ИПСК. Благодаря стволовым клеткам перед нами открывается огромное поле возможностей, но впереди еще большее поле научной работы.
Источник: БИОМОЛЕКУЛА