Развитие биотехнологий открыло новые возможности использования живых организмов на благо человечества. Методы генетической инженерии позволяют производить различные вещества в живых объектах, следовательно, мы можем использовать эти объекты в качестве природных «фабрик». Центральная догма молекулярной биологии в общем случае гласит: ДНК → РНК → белок. Именно белок часто является конечным продуктом биотехнологического производства: это может быть инсулин, интерфероны, антитела, ферменты, вакцины... Нам лишь нужно задать программу и «записать» ее в ДНК, а живой объект всё сделает сам. В качестве «фабрик» используют клетки дрожжей, бактерий, растений, а также культуры клеток насекомых и млекопитающих. В этой статье речь пойдет о растительных биофабриках.
Что такое растение-биофабрика?
Как объяснить понятие «растение-биофабрика»? Можно сказать, что это природное предприятие, которое будет изготавливать нужный нам биопродукт. В отличие от обычной фабрики, на таком предприятии будут трудиться не рабочие, а компоненты клеток: полимеразы нуклеиновых кислот, рибосомы, тРНК и многие другие. А производить они будут белок.
Почему именно растения?
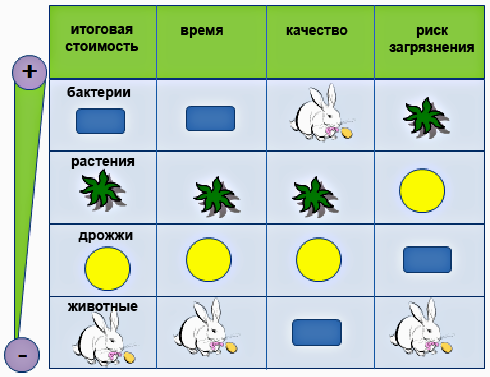
Рисунок 1. Сравнение систем продукции рекомбинантных белков (от самых привлекательных «+» до наименее привлекательных «—»).
В настоящее время для наработки белков чаще всего используют бактерий, дрожжи, культуры клеток насекомых и млекопитающих. Очень привлекательной системой синтеза и накопления рекомбинантных белков (экспрессионной системой) являются и растения, и тому есть несколько причин. Прежде всего, в растительных тканях нет риска загрязнения рекомбинантного белка вирусами животных и прионами — инфекционными белками. Растительные клетки обеспечивают правильную модификацию рекомбинантного белка, характерную для эукариотических клеток. Также большое значение имеют стоимость, простота и время. На рисунке 1 сравнивается несколько основных экспрессионных систем.
Из таблицы видно, что идеальной системы экспрессии не существует. Сегодня в России шире всего распространены бактериальные системы с E. coli в качестве самой популярной «рабочей лошадки». Еще в 2009 г. на долю этого микроорганизма приходилось 85% от всех систем экспрессии, несмотря на ряд существенных недостатков.
У каждой биофабрики есть свои плюсы и свои минусы. Но растительная система для многих ситуаций оказывается наиболее привлекательной.
Как заставить растение производить белок?
Для того чтобы растение производило нужный белок, в клетки этого растения необходимо внести чужеродный генетический материал — последовательность ДНК, кодирующую аминокислотную последовательность нужного белка.
Первый этап модификации растений с применением методов генетической инженерии включает поиск и выделение (или синтез) генов, которые будут перенесены в растительный геном. Гены, представляющие интерес для биотехнологов (целевые гены), могут быть «выращены» химическим путем, а также наработаны с помощью ПЦР (полимеразной цепной реакции). Затем целевой ген встраивается в подходящий вектор*, который и доставляет его к месту производства белка — подобно тому, как вагон с сырьём прицепляется к паровозу, направляющемуся к фабрике.
Как перенести в растительную клетку необходимую последовательность ДНК?
В настоящее время чаще используют два способа.
Первый связан с использованием природных генно-инженерных «навыков» почвенной агробактерии Agrobacterium tumefaciens, способной переносить фрагменты ДНК в растительную клетку, то есть модифицировать ее генетически. Этот процесс в природе происходит повсеместно и регулярно. В природной A. tumefaciens помимо хромосомы содержится Ti-плазмида, в состав которой входит так называемая Т-ДНК (transferred DNA) длиной 12–22 т.п.н., встраивающаяся в ДНК растительной хромосомы. Она кодирует ферменты синтеза фитогормонов и опинов — производных аминокислот, которые используются бактерией как источник углерода, азота и энергии.
Т-ДНК Ti-плазмид обладает двумя свойствами, делающими ее почти идеальным вектором для введения чужеродных генов в клетки растений. Во-первых, круг хозяев агробактерий очень широк: они трансформируют клетки практически всех двудольных растений (а при некоторых стараниях можно добиться заражения и однодольных, в том числе злаков). Во-вторых, интегрированная в геном растения Т-ДНК наследуется как простой доминантный признак в соответствии с законами Менделя. Простейший способ введения Т-ДНК в клетки растения — заражение его A. tumefaciens, содержащей подходящую Ti-плазмиду, дальнейшее же предоставляется естественному ходу событий. Необходимо только уметь встраивать нужные гены в Т-сегмент плазмидной ДНК.
После проникновения агробактерий в межклеточное пространство Т-ДНК переносится из агробактерии в ядро растительной клетки и встраивается в хромосомную ДНК. Далее происходят транскрипция и трансляция — синтезируется целевой белок. Сама бактерия в клетку при этом не проникает, а остается в межклеточном пространстве.
Второй способ — баллистическая трансформация с использованием генной пушки. Маленькие золотые или вольфрамовые частицы покрывают чужеродной ДНК и «выстреливают» в молодые растительные клетки. Этот метод позволяет встраивать нужные гены не только в хромосомы растений, но и в геном их органелл — пластид. Это очень полезно в первую очередь для получения растений, защищенных от вредителей, но при этом безопасных для опылителей: ведь трансгены не экспрессируются в не имеющих пластид цветках. Недавно таким способом создали трансгенный (а именно — транспластомный) картофель, в хлоропластах которого образуется и сохраняется неповрежденной двухцепочечная РНК, блокирующая синтез жизненно важного белка колорадского жука — β-актина. Поедая листья такого картофеля, личинки жуков погибают в считанные дни.
Менее распространенные, но всё же действенные способы трансформации — электропорация и трансформация с помощью вирусов.
Постоянная и временная экспрессия гена
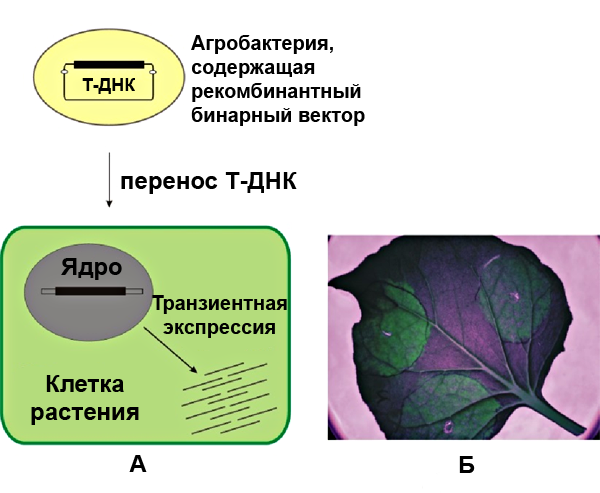
Рисунок 2. Транзиентная экспрессия чужеродных генов в растениях с помощью агроинфильтрации. А — общий механизм процесса, Б — визуализация синтезируемого в растении репортера — GFP (зеленого флуоресцентного белка) — освещением листа ультрафиолетом.
В генетической инженерии растений можно встретить такие понятия: генетически модифицированное (ГМ, или трансгенное) растение и растение, обеспечивающее транзиентную (временную) экспрессию гена. В чем же разница?
Если речь идет о трансгенном растении, то подразумевается, что чужеродная ДНК интегрирована в хромосому. К настоящему времени получены десятки видов трансгенных растений, в геном которых перенесена ДНК, кодирующая различные белки медицинского назначения, такие как антигены различных возбудителей инфекционных заболеваний, терапевтические белки и моноклональные антитела. Однако количество синтезируемого целевого белка в таких растениях обычно небольшое (менее 1% от общего растворимого белка).
При транзиентной экспрессии ДНК обычно не включается в ядерный геном, не реплицируется и не передается по наследству. Этот вид экспрессии не постоянный, однако некоторое время в одной клетке может присутствовать большое количество копий чужеродной ДНК, что обеспечивает высокий уровень синтеза конечного продукта. При наработке белков в растениях данный вариант наиболее эффективен. Мы как бы арендуем фабрику, и это оказывается более рентабельным, чем ее покупка. На рисунке 2 представлена модель переноса в растительную клетку ДНК для транзиентной экспрессии (в роли курьера — Agrobacterium tumefaciens).
Что может производить растение-биофабрика?
Использование растений в биотехнологии развивается в нескольких направлениях (рис. 3).
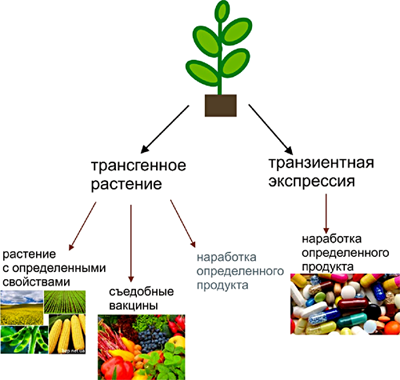
Рисунок 3. Возможности использования растений в биотехнологических целях.
Первое направление включает в себя создание растений с новыми свойствами. О несомненных плюсах трансгенных растений сказано немало. Так, ведется разработка сортов, устойчивых одновременно к насекомым-вредителям и болезням, вызываемым вирусами, плесневыми грибками и бактериями. Идут исследования, которые позволят вывести сорта сельскохозяйственных культур, переносящих неблагоприятные климатические и химические условия, например, засуху и засоленность почвы. Создаются продукты, в которых значительно увеличена доля полезных и питательных веществ, снижено содержание насыщенных жиров и аллергенов. Особое внимание уделяется разнонаправленным модификациям риса — ценного и относительно недорогого продукта питания, который можно было бы производить во всех беднейших регионах мира, включая засушливые.
В эту же группу можно отнести трансгенные растения, которые используются в качестве модельных объектов для изучения фундаментальных проблем функционирования генов.
Многие ГМ-растения сейчас находятся в массовом производстве. Это соя, кукуруза, картофель, маслянистые растения (рапс и подсолнух) и многие другие (рис. 4). Странами-лидерами в производстве таких растений являются США, Канада, Аргентина и Бразилия. Догоняют их Китай и Япония. С рядом растений работают некоторые страны ЕС и Австралия.
Среди компаний, разрабатывающих трансгенные растения, можно отметить Calgen, Monsanto, Ciba Seeds. Несмотря на то, что ГМ-растения продаются на многих рынках мира, дискуссии о безопасности их использовании еще не закончены. Больше всего слухов и скандалов разворачивается вокруг компании «Монсанто». Основная продукция этой фирмы — генетически модифицированные семена кукурузы, сои, хлопка, а также самый распространенный в мире гербицид «Раундап» (непатентованное название — глифосат).
Основанная Джоном Фрэнсисом Куини в 1901 году как чисто химическая компания, «Монсанто» эволюционировала в концерн, специализирующийся на высоких технологиях в области сельского хозяйства. Ключевым моментом в этой трансформации стал 1996 год, когда «Монсанто» выпустила на рынок первые генно-модифицированные сельскохозяйственные культуры: сою «Раундап Рэди» (Roundup Ready, RR), устойчивую к глифосату, и хлопок «Боллгард» (Bollgard), устойчивый к насекомым-вредителям (гусеницам).

Рисунок 4. Примеры трансгенных растений.
В марте 2005 года «Монсанто» приобрела крупнейшую семеноводческую компанию Seminis, специализирующуюся на производстве семян овощей и фруктов, в 2007–2008 годах поглотила 50 компаний — производителей семян по всему миру, после чего подверглась жесткой критике со стороны общества. В знак протеста против генетических манипуляций биотехнологического гиганта 25 мая 2013 года прошел «Марш против „Монсанто“», в котором приняли участие более 2 млн человек на шести континентах, в 52 странах мира.
В Центре «Биоинженерия» Российской академии наук на протяжении двух десятилетий ведутся работы по генетической инженерии растений — как для фундаментальных исследований, так и для сельского хозяйства. Были созданы генетически модифицированные сорта картофеля, устойчивые к колорадскому жуку, сорта свёклы, устойчивые к гербицидам и вирусам и др. Эти культуры могли бы решить ряд задач сельского хозяйства, но из-за до сих пор действующего в России законодательного ограничения они не выращиваются в открытом грунте. Само собой, этот запрет более чем странен, ведь ввоз ГМ-продукции в страну разрешен.
Второе направление представляет собой создание съедобных вакцин. В данном случае получают генно-модифицированное растение, синтезирующее вакцину. Такой привлекательной кажется идея: лежишь под пальмой, ешь банан, и ни одна тропическая зараза не берет!

Рисунок 5. Препарат трипсина, полученного в растениях (Sigma).
Концепцию производства вакцин в растениях впервые сформулировал Xью Мэйсон с соавторами. Они предприняли попытку получения съедобной вакцины против вируса гепатита В на основе трансгенного табака. На следующем этапе был создан ГМ-картофель, продуцирующий поверхностный антиген вируса гепатита В. При скармливании мышам клубней такого картофеля наблюдали развитие специфического иммунного ответа. В 1999 г. были начаты эксперименты на добровольцах, и у людей, употреблявших в пищу сырые клубни картофеля, наблюдали формирование специфического иммунитета. Также были получены съедобные вакцины против вируса гепатита В на основе люпина и салата.
Созданы трансгенные растения картофеля и табака, производящие белок нуклеокапсида вируса Норфолк, вызывающего у людей острый гастроэнтерит и устойчивого к спиртовым антисептикам. Появился и трансгенный картофель, синтезирующий полипептид LT-B — субъединицу термолабильного токсина Е. coli, вызывающего диарею. Однако, несмотря на активные исследования в этой области, коммерческих препаратов на сегодняшний день нет.
Третье направление связано с наработкой в растениях определенных продуктов, которые затем выделяются из растений и могут быть использованы, например, в качестве лекарственных препаратов. Биотехнологическими компаниями по всему миру уже создано большое количество ГМ-растений для получения белков, в том числе и медицинского назначения. Среди компаний, деятельность которых основана на использовании трансгенных растений, следует отметить фирмы Рrotalix (Израиль), Medicago (Канада), LemnaGene (Франция), Planet Biotechnology (США), ProgyGene (Люксембург), Сhlorogen Inc. (США), SemBioSys Genetics (Канада) и Bayer AG (Германия). Из белков медицинского назначения у производителей наиболее популярны инсулин, лизоцим, лактоферрин, коллаген, липаза, антитела, вакцины и др. Многие из этих препаратов уже проходят клинические испытания. А вот трипсин уже можно купить у компании Sigma (рис. 5).
При наработке в растительных клетках продуктов медицинского назначения тоже используют метод агробактериальной трансформации, обеспечивающей транзиентную экспрессию генов на высоком уровне. Очевидными преимуществами этих систем являются простота манипуляций, скорость, низкая стоимость и высокий выход конечного продукта. Кроме того, в данном случае возможен синтез сложных белков, состоящих из нескольких субъединиц. Этот способ позволяет получать в течение нескольких дней белок в больших количествах (до нескольких граммов белка на килограмм массы растения). Выход продукта начинается уже через три часа (!) после проникновения агробактерий в клетку и переноса ДНК, а экспрессия сохраняется до 10 дней. Максимум наработки определяется для каждого белка индивидуально, но в среднем это 3–4 суток. Суммарно на получение белков в растениях уходит 2–3 недели (рис. 6).
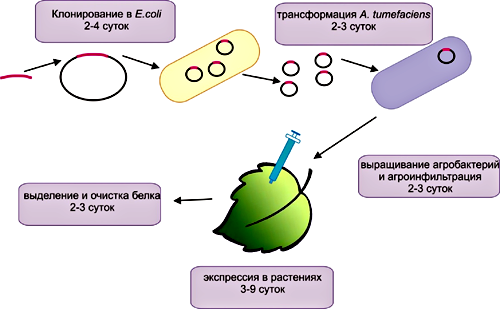
Рисунок 6. Принципиальная схема экспрессии генов целевых белков в растениях. Весь процесс получения белка занимает 2–3 недели.
В растениях уже нарабатываются вакцины от вирусов папилломы человека, гепатита В, гриппа, папилломы крупного рогатого скота, африканской катаральной лихорадки, герпеса рогатого скота, ящура и др.
В Центре «Биоинженерия» также ведутся работы по экспрессии терапевтических белков в растениях. Так, в клетках Nicotiana benthamiana (вид табака) были произведены вакцинные препараты против вируса гриппа. Основой препарата служит высококонсервативный вирусный белок M2, который присоединен к белку-носителю для увеличения иммуногенности. Носителем может быть кóровый белок вируса гепатита В или бактериальный флагеллин. В случае флагеллина вакцинный препарат применяют интраназально, что является явным преимуществом. А использование высококонсервативной последовательности белка M2 делает вакцину универсальной, что исключает необходимость изготовления каждый год всё новых и новых ее вариантов. Эти вакцинные препараты показали хорошие результаты по иммуногенности и протективности в экспериментах с лабораторными животными; следующим этапом должно стать клиническое тестирование.
Об успехах в мире
Персонифицированная терапевтическая вакцина для лечения лимфомы, полученная с помощью транзиентной экспрессии в растении Nicotiana benthamiana, уже прошла I и II фазы клинических испытаний. На данный момент (2015 год) ожидается старт III фазы. Растительная вакцина против пандемического гриппа H5N1 проходит II фазу клинических испытаний, результаты будут опубликованы в июне 2015 г. Вакцина была разработана компанией Medicago. Стандартный процесс получения этой компанией вакцинных белков в растениях показан на видео.
Клинические испытания вакцинных препаратов занимают продолжительное время (около 10 лет). Невольно возникает вопрос с вакциной от гриппа, так как каждый год появляются новые штаммы, и будет ли прошедшая клинические испытания вакцина актуальной? Здесь большее значение имеет технология получения препарата. Новый тип вакцины проходит полный цикл клинических испытаний, а затем уже по отработанной методике может быть получена вакцина с учетом циркулирующих штаммов вируса. Так, сейчас сезонные профилактические прививки от гриппа получают в куриных яйцах, и такие вакцины уже не проходят клинических испытаний. Как будут обстоять дела с производством в растениях рекомбинантных вакцин для массового применения, покажет время.
Источник: БИОМОЛЕКУЛА


