Онкологические заболевания были бы еще страшнее, будь они трансмиссивными, то есть если бы они передавались непосредственно раковыми клетками от больного человека здоровому. К счастью, иммунная система уничтожает раковые клетки чужого организма подобно тому, как она отторгает пересаженные органы и ткани. Существуют перевиваемые опухоли, которыми экспериментаторы заражают лабораторных животных, но такие опыты проводят на специальных линиях генетически идентичных грызунов. Иногда лабораторным животным пересаживают даже человеческую опухоль, но у этих животных подавляют иммунитет (модели ксенографтов). В естественных условиях рак не заразен, если не вызван инфекционными агентами, например онкогенными вирусами. Но, как оказалось, некоторым животным не повезло. В настоящее время известны три злокачественные трансмиссивные опухоли. По происхождению клетки каждой опухоли представляют собой клоны, то есть имеют общего предка; за время существования они обросли мутациями и генетически не вполне идентичны друг другу, хотя достаточно однородны.
Старейшая клеточная линия
В странах с умеренным климатом среди диких и бездомных псов распространена трансмиссивная венерическая опухоль собак (ТВОС). В разных странах ею страдают 1–10% собак, в Канаде, Великобритании, некоторых европейских странах и в Новой Зеландии болезнь практически побеждена благодаря высокому уровню ветеринарной помощи (опухоль хорошо поддается лучевой и химиотерапии).

Первая собака, заболевшая трансмиссивным раком, могла выглядеть примерно так
ТВОС хорошо изучена, впервые ее как саркому Стикера описал в 1810 году лондонский практикующий ветеринар, а в 1876 году российский ветеринарный врач Мстислав Александрович Новинский доказал ее трансмиссивность, натерев опухолью слизистую оболочку половых органов здорового животного. Современные исследования подтвердили, что никаких инфекционных агентов, ответственных за возникновение и передачу опухоли, нет. Здоровые животные заражаются ею в результате естественного переноса живых раковых клеток. Передается ТВОС половым путем и поражает наружные половые органы самцов и самок. Спаривание собак заканчивается длительным «замком», при котором гениталии животных тесно соприкасаются. При этом слизистые оболочки нередко повреждаются, что способствует распространению опухоли. Она ярко-розового цвета, состоит из нескольких долей и достигает 10 см в диаметре. Долгое время исследователи считали, что ТВОС не дает метастазов, однако в последние годы обнаруживают до 5–7% случаев метастазирования.
Опухолью можно заразить и других псовых — волков, лисиц и койотов; попытки пересадить ее мышам, крысам, хомякам и кошкам окончились безрезультатно.
Отчасти с венерической трансмиссивной опухолью собакам повезло, потому что она не только легко лечится, но часто сама рассасывается. Различные данные указывают на разную частоту и сроки регрессии, которые зависят от состояния иммунной системы и генотипа животного. Механизм регрессии не вполне ясен. После того как опухоль рассосалась, собака приобретает иммунитет к повторному заражению, а ее сыворотка защищает от трансмиссии еще не болевших животных.
По данным гистологов и иммунологов, клетки ТВОС произошли от клеток миелоидного ряда, возможно тканевых макрофагов. Генетики постарались установить время возникновения опухоли и облик прародителя. Они сравнили геномные последовательности опухолей из двух разных популяций: одичавших собак Австралии и американского кокер-спаниеля из Бразилии, а также последовательности ДНК раковых клонов и геномов разных пород собак, волков и койотов. Ученые пришли к выводу, что опухоль возникла около 11 тысяч лет назад. Недавние исследования позволили сопоставить последовательности определенных генов и внешние признаки собаки. Проанализировав эти последовательности в клетках ТВОС, ученые пришли к выводу, что опухоль возникла у крупной или средней собаки окраса черного или агути (каждый волос имеет черный кончик, затем желтую зону, потом снова черную и светлое основание). В ее геноме присутствовали волчьи аллели, следовательно, это был представитель одной из древнейших пород собак, прародитель аляскинского маламута, хаски и некоторых других. Опухоль долгое время существовала в довольно изолированной популяции с небольшим генетическим разнообразием, а примерно 460 лет назад стала распространяться по миру.
Одиннадцать тысяч лет опухолевые клоны переходили от одного хозяина другому, и ТВОС по праву считают старейшей непрерывно размножающейся клеточной линией. За это время ее клетки накопили 1,9 млн мутаций: однонуклеотидных замен, инсерций, делеций и структурных перестроек, которые затронули более 10 тысяч генов. Это в сотни раз больше, чем в раковых клетках человека. Многие из этих мутаций напоминают те, что возникают под действием ультрафиолета в клетках меланомы человека. Очевидно, эволюция ТВОС также проходила при ультрафиолетовом излучении низкой интенсивности: хотя опухоли развиваются внутри генитального отверстия, они иногда выступают на поверхность. Мутации затрагивают все этапы иммунного ответа организма, регуляцию активности генов, некоторые ключевые онкогены. Эта всеохватность — результат тысяч лет отбора.
Дьявольская опухоль
Другая трансмиссивная опухоль несравненно моложе ТВОС и четко локализована географически. Лицевую опухоль тасманийского дьявола (ЛОТД) обнаружили на севере Тасмании в 1996 году, за десять лет она распространилась по всему острову и приняла характер эпидемии, поставив сумчатых тасманийских дьяволов Sarcophilus harrisii на грань исчезновения.
Опухоль поражает кожу на морде и слизистые оболочки ротовой полости, быстро разрастается, вызывая некрозы и язвы. Примерно в 65% случаев она образует метастазы во внутренние органы, преимущественно в легкие. Летальность у нее абсолютная, через 3–9 месяцев животное погибает от голода, удушья или злокачественных опухолей во внутренних органах. ЛОТД распространяется через укус: тасманийские дьяволы имеют антисанитарную привычку покусывать друг друга во время спаривания или совместного поедания найденной падали. Хотя опухоль не венерическая, детеныши ею не болеют; возможно, чтобы быть укушенными во время общей трапезы, им нужно достигнуть зрелого возраста.

Тасманийские дьяволята не болеют лицевой опухолью
В 2006 году тасманийские исследовательницы Анна-Мари Перс и Кейт Свифт обнаружили, что опухоль трансмиссивна, поскольку все ее клетки имеют идентичные хромосомные перестройки, то есть представляют собой клоны. Позже это подтвердили исследования мтДНК из 104 опухолей. В этой работе принимала активное участие британская исследовательница Элизабет Мурчисон, которая изучала и геном ТВОС. Судя по белкам, которые экспрессирует ЛОТД, предком опухоли была шванновская клетка (эти клетки образуют миелиновую оболочку нервных волокон). ЛОТД видоспецифична, привить ее мышам не удалось, у других сумчатых Тасмании ее не обнаружили, хотя заражать их экспериментально не пытались.
Определив геномные последовательности двух здоровых тасманийских дьяволов и двух клеточных линий опухоли, ученые обнаружили в каждой линии 15–17 тысяч соматических мутаций. Мутации позволяют раковым клеткам ускользать от иммунной системы хозяина, в этом им помогает и генетическое сходство животных. Особи из шести разных регионов генетически очень близки. Виной тому ограниченный ареал обитания и эффект основателя, поскольку островная популяция тасманийских дьяволов — потомки нескольких животных.
В 2014 году у пяти самцов на юго-востоке Тасмании обнаружили новый клон ЛОТД. Внешне опухоли ЛОТ1 и ЛОТ2 неотличимы, но гистологически различаются, и генетические маркеры у них разные. Удивительно, что новый клон трансмиссивного рака появился опять-таки в Тасмании. Возможно, тасманийские дьяволы обладают повышенной чувствительностью к новообразованиям, и вкупе с привычкой кусаться и низким генетическим разнообразием это стало причиной высокой уязвимости. Но если это так, странно, что до 1996 года о ЛОТД ничего не было известно. Не исключено, что на животных подействовали какие-то новые факторы, в том числе антропогенные, или патогены. Второе объяснение заключается в том, что трансмиссивные виды рака на самом деле встречаются чаще, чем принято считать.
Как бы то ни было, тасманийские дьяволы могут исчезнуть в течение 35 лет. Специалисты Тасманийского университета разрабатывают вакцину на основе мертвых клеток ЛОТД. Она защитила одно животное из шести, причем ее действия хватило на год, затем иммунизацию необходимо повторить. Пока вакцину совершенствуют, единственный выход, по мнению ученых, состоит в изоляции здоровых животных и разработке методики выбраковки больных дьяволов из популяции. Но что бы ни предприняли люди, делать это надо очень быстро.
И хомяки заодно

Сирийские хомячки заражались раком в виварии
В 1945–1981 годах в научной периодике появлялись сообщения о трансмиссивных опухолях сирийских хомячков Mesocricetus auratus, разводимых в вивариях. В отличие от трансмиссивных опухолей домашних собак и тасманийских дьяволов, которые, раз возникнув, десятилетиями, а то и веками передаются от зверя к зверю, трансмиссивные опухоли хомячков спонтанно возникали в различных экспериментальных популяциях. Это чрезвычайно агрессивные опухоли, метастазы образуются чуть ли не в день заражения. Вирусов, ответственных за развитие этих опухолей, не обнаружили. В 1975 году появилось сообщение об эпидемии лимфомы, спонтанно возникшей в виварии, где разводили беспородных хомячков. Эпидемия не была связана с царапаньем, кусанием, половыми контактами или поеданием раковых клеток (хомячки иногда грызут опухоли, и у них возможен каннибализм). Когда к заболевшим животным подсаживали здоровых хомячков, у них развивался тот же тип опухоли, несмотря на почти стерильную чистоту в виварии. Возможно, опухоль переносили комары, причем они служили пассивными переносчиками, и раковые клетки в них не размножались. В естественных условиях эпидемии лимфомы не описаны.
Бесконтактная трансмиссия
Третья из ныне известных трансмиссивных опухолей, циркулирующая в естественных условиях, обнаружена у двустворчатого моллюска — песчаной ракушки Mya arenaria. Этот съедобный моллюск, обитающий у восточного побережья Северной Америки, с конца 1970-х годов страдает чем-то похожим на лейкемию. У моллюсков не кровь, а гемолимфа. Сосуды, по которым она течет, не замкнуты, ее клетки гемоциты выполняют в организме моллюска защитные функции, аналогично фагоцитам млекопитающих. При опухоли гемоциты активно делятся, меняют форму (рис. 1), теряют способность к фагоцитозу и забивают гемолимфу и ткани песчаной ракушки, вызывая ее гибель. Во многих местах моллюски практически исчезли.
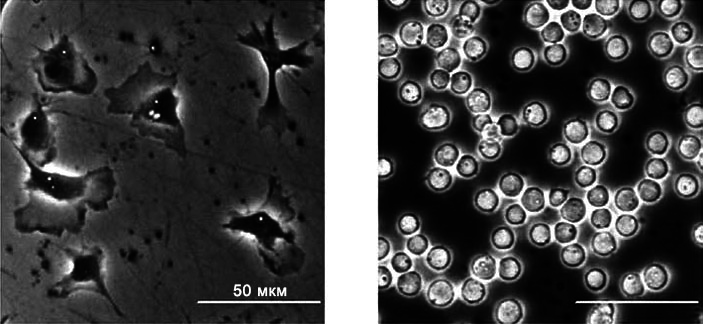
Рис. 1. Гемоциты песчаной ракушки Mya arenaria, здоровые (слева) и неопластические (справа). Опухолевые клетки теряют характерную отросчатую форму, становятся мелкими и круглыми
«Лейкозы» песчаной ракушки активно изучают специалисты Колумбийского университета (США) и канадские экологи. Проанализировав геномную и мтДНК опухолевых клеток, они обнаружили, что генотипы опухоли не совпадают с генотипами хозяев. Более того, все неопластические гемоциты песчаных ракушек, рассеянных вдоль атлантического побережья Северной Америки, — потомки одной раковой клетки. Механизм, посредством которого клетки могут передаваться от животного к животному на расстояния в сотни километров, неясен. Ракушки друг с другом не контактируют. Осев на дно личинкой, моллюск так и остается на одном месте. Пищу он добывает, фильтруя морскую воду. Возможно, таким же образом в организме оказались и клетки опухоли. Эксперименты показали, что они выживают в морской воде более шести часов. В воду же они могли попасть во время болезни, нереста или после смерти больного моллюска. Люди в последнее десятилетие активно разводили песчаных ракушек и перемещали их вдоль побережья, чем, вероятно, поспособствовали распространению опухоли.
Похожие опухоли развиваются и у других двустворчатых моллюсков в том же регионе Северной Америки, например у мидий и устриц. Пока неизвестно, получены ли эти опухоли от песчаной ракушки или каждый вид имеет свой собственный трансмиссивный рак. Межвидовая передача опухоли возможна; как мы помним, ТВОС поражает не только собак, но и других псовых. Исследователи планируют определить происхождение раковых клеток у других моллюсков. Если опухоли окажутся видоспецифичными, то, возможно, у атлантического побережья Америки сформировалась особая среда, благоприятная для одновременного возникновения нескольких трансмиссивных раков. Для людей эти опухоли не опасны, но моллюски погибают, и пока единственный возможный выход — карантин, который помешает распространению болезни дальше на юг, к побережью Флориды.
Как они это делают?
Способность трансмиссивных опухолей колонизировать новых хозяев противоречит традиционным представлениям о реакции иммунной системы на чужеродные ткани. Давайте запомним термин «аллографт». Так называют трансплантат (ткань или орган), выделенный от одной особи и пересаженный особи того же вида, но другого генотипа, то есть от собаки к собаке, от человека к человеку. Чужие раковые клетки — тоже аллографт. Прижиться на новом месте ему мешает барьер гистосовместимости. В крайне упрощенном виде он выглядит так. На поверхности почти каждой эукариотической клетки млекопитающего присутствуют белки главного комплекса гистосовместимости I класса (по-английски major histocompatibility complex, сокращенно MHC). Их разнообразие настолько велико, что нет двух особей с одинаковым набором белков MHC, если они не однояйцевые близнецы. Различия между MHC I донора и реципиента служат причиной отторжения трансплантата. Цитотоксические Т-клетки иммунной системы постоянно инспектируют MHC I. Обнаружив их чужеродность, они выделяют белок перфорин, который дырявит мембрану клетки-носителя и губит ее. На чужие MHC I реагируют также клетки-хелперы, активирующие В-клетки, которые синтезируют антитела против трансплантата.
Беспозвоночные, подобные двустворчатым моллюскам, не имеют такой сложной системы распознавания тканей, как барьер гистосовместимости, поэтому они должны быть более восприимчивы к трансмиссивным опухолям. Исследователи отмечают, что в раковых клетках моллюсков изменена активность многих генов, и планируют разобраться, какие именно мутации привели к возникновению фенотипа опухоли.
Что касается трансмиссивных опухолей млекопитающих, их распространение поначалу облегчалось низким генетическим разнообразием и изоляцией хозяйских популяций. ТВОС впервые возникла в обособленной популяции собак, в которой и развивалась несколько тысяч лет, пока не начала распространяться по всему миру. Тасманийские дьяволы до сих пор изолированы, и последовательности генов MHC разных особей очень схожи. Тем не менее низкое разнообразие MHC не может объяснить трансмиссивность опухоли, потому что кожные аллографты тасманийские дьяволы отторгают в течение 14–21 дня.
Значительная часть клеток трансмиссивных опухолей не имеет на поверхности молекул MHC I, благодаря чему они остаются неузнанными для Т-лимфоцитов. На аллографты без белков MHC должны реагировать другие иммуннокомпетентные клетки, нормальные киллеры (НК), но почему-то этого не делают. И все же клетки ТВОС и ЛОТД сохранили способность в определенных условиях экспрессировать MHC. Опухоль тасманийского дьявола реагирует таким образом на введение γ-интерферона (но иммунокомпетентные клетки все равно с ней не справляются), а собачья опухоль обрастает антигенами перед регрессией. Значит, последовательности генов MHC в порядке, а не экспрессируются они благодаря мутациям в генах, влияющих на структуру клеточных мембран, образование, транспорт и презентацию антигенов на поверхности клеток. Значительная часть этих генов известна, но обсуждать мы их сейчас не будем, чтобы не усложнять рассказ. В опухолях тасманийских дьяволов на экспрессию белков MHC, возможно, влияет изменение уровня метилирования ДНК, определяющего структуру хроматина. Еще один метод защиты от иммунной системы хозяина — синтез иммуносупрессоров.
Особый интерес исследователей вызывает феномен регрессии ТВОС: они надеются, что понимание механизма этого процесса позволит добиться регрессии других трансмиссивных опухолей, а возможно, и нетрансмиссивных тоже. Пока известно немного. В растущую опухоль проникают Т- и В-лимфоциты, вероятно, и НК-клетки. Затем на поверхности раковых клеток появляются белки MHC, и рост опухоли сменяется регрессией. При этом лимфоциты активно выделяют провоспалительные цитокины интерлейкин-6 и γ-интерферон. Что служит сигналом к переходу от роста ТВОС к регрессии, исследователи не знают.
В глубь ЛОТД Т-лимфоциты не могут проникнуть и толпятся по краям. Не исключено, что раковые клетки создают определенную микросреду, которая в одних случаях пропускает Т-лимфоциты внутрь, а в других нет.
Как бы то ни было, ученые пока не могут в деталях объяснить способность трансмиссивных опухолей ускользать от иммунной системы.
Паразит превращается в опухоль
Клетку, проникшую в чужой организм и размножающуюся в нем, можно уподобить паразиту. И если трансмиссивная опухоль ведет себя как паразит, почему бы паразиту не стать опухолью?
Пока известно три таких случая. В 1968 году во время очередного курса химиотерапии умер пациент с болезнью Ходжкина, и при вскрытии у него обнаружили структуры, напоминающие цисты паразитических червей, рассеянные во внутренних органах, кровеносных сосудах, лимфатических узлах и подкожных тканях. Морфологи решили, что это аберрантные личинки карликового цепня Hymenolepis nana. Образцы тканей сохранили и в 2003 году провели анализ ДНК, который подтвердил диагноз паразитологов. В 1996 году пострадал мужчина 44 лет с множественными опухолями в печени и лимфатических узлах. Он жаловался на боли, лихорадку, потерю веса и умер через 10 недель. В его тканях нашли скопления цист цепня Skrjabinoporus merops. Этот червь — паразит тропических неводных птиц. Людей он обычно не заражает, но его яйца могли попасть в организм случайно с каким-то продуктом, загрязненным птичьими фекалиями, и у иммунодефицитного пациента, изнуренного лучевой и химиотерапией, развилась инфекция.
Лучше всего изучено заболевание 41-летнего колумбийца, больного СПИДом и зараженного карликовым цепнем, с небольшими опухолями в легких и лимфатических узлах (рис. 2). Пациента обследовали специалисты Государственного центра по контролю и профилактике заболеваний в Атланте, США, а когда он скончался в мае 2013 года, они изучили образцы тканей.
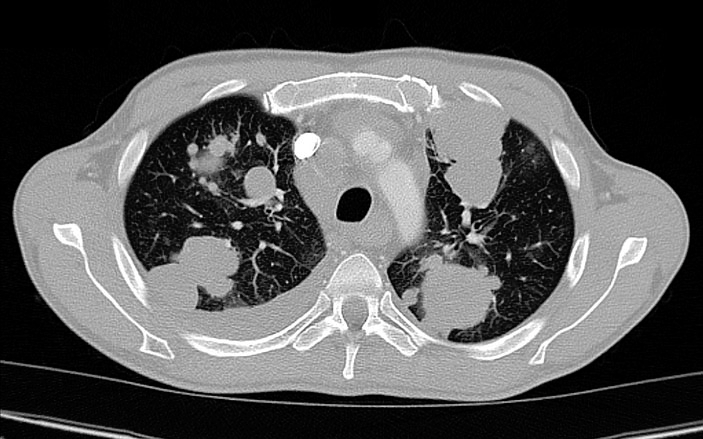
Рис. 2. Компьютерная томограмма грудной клетки (поперечный срез). В легких видны множественные опухоли, образованные клетками карликового цепня
Клетки опухоли выглядели как злокачественные: мономорфные, с большим ядром, их отличал неупорядоченный рост и инвазия в другие ткани. По их внешнему виду нельзя было заключить, что они принадлежат сложному многоклеточному организму, такому как солитер. Однако анализ ДНК показал, что это клетки карликового цепня H. nana. Данный случай не похож на два предыдущих, когда принадлежность клеток червю определялась на глаз.
Карликовый цепень отличается от нескольких тысяч других видов солитера тем, что проходит весь цикл развития в кишечнике млекопитающего. Инфекция протекает практически бессимптомно. Иногда личинки червя попадают из кишечника в лимфатические узлы, а оттуда в другие органы. Здоровая иммунная система не позволяет им там развиваться, но у больного был СПИД.
В личинках плоских червей много плюрипотентных стволовых клеток. Оказавшись в новой среде, не получая от нее привычных сигналов, они вместо того чтобы дифференцироваться и образовывать взрослого червя стали просто делиться. Исследователи обнаружили мутации в нескольких регуляторных генах, соответствующих онкогенам млекопитающих. Эти мутации способствуют длительной клеточной пролиферации.
Злокачественная трансформация H. nana может быть распространена в странах, где часто встречаются СПИД и паразитарная инфекция. Инфекция легко излечивается даже на стадии тканевой инвазии личинок, неизвестно, однако, насколько лекарство эффективно в случае бесконтрольного деления стволовых клеток червей. Паразитические черви обычно обладают клеточными механизмами инвазии в хозяйские ткани и защиты от иммунной системы. Эти механизмы могут быть использованы во время злокачественной трансформации в организме хозяина. Возможно, связь между инфекцией и раком сложнее, чем принято считать. Заразна ли опухоль, вызванная H. nana, ученые не знают.
Настоящие трансмиссивные опухоли у человека тоже встречаются, хотя и редко. Подобные случаи связаны в основном с беременностью или трансплантацией, крайне редко они происходят во время хирургических операций. Пересадка органов и тканей сопровождается иммуносупрессией, что создает благоприятные условия для передачи раковых клеток. Как правило, в организм реципиента проникают клетки меланомы и лейкемии / лимфомы в основном из-за высокой способности этих опухолей к метастазированию. Описаны два случая инфекции при беременности. Эмбрион и плацента — иммунопривилегированные области, в которых появление антигена не вызывает иммунной реакции. В одном случае мать болела лейкемией, и клетки опухоли попали в семенники плода, еще один иммунопривилегированный орган. У младенца развилась лимфома, его пришлось оперировать. Во втором случае геном лейкозных клеток матери содержал делецию, затронувшую область генов гистосовместимости, поэтому организм младенца не воспринял эти клетки как чужеродные и опухоль прижилась.
Пока спонтанный трансмиссивный рак описан только у четырех видов на всей планете, три из которых — млекопитающие (рис. 3), и ученые не исключают появления у них новых видов трансмиссивных опухолей. Возможно, способы передачи будут другими, например лактация. Млекопитающие (а их 5500 видов) составляют лишь десятую часть от общего количества видов позвоночных, и существует много типов злокачественных опухолей птиц, амфибий, рептилий и рыб. Можно было бы ожидать, что у них и трансмиссивные опухоли обнаружат, но нет.
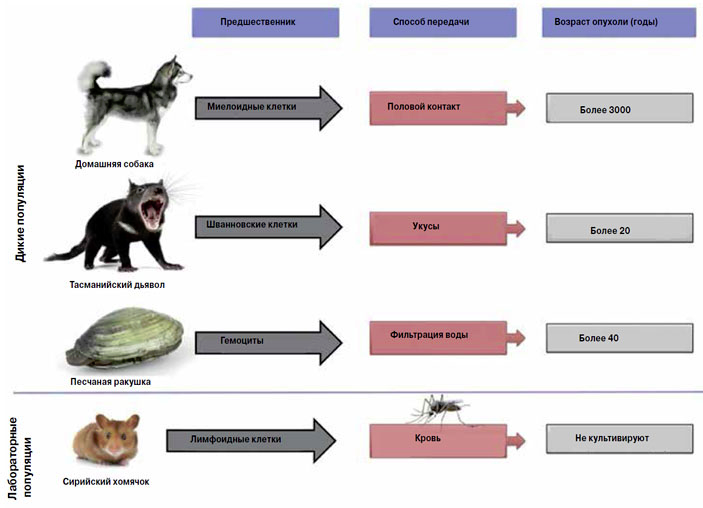
Рис. 3. Известные случаи спонтанных трансмиссивных злокачественных опухолей
Почему сложилась такая ситуация, непонятно. Может быть, млекопитающие оказались особенно подходящим таксоном для развития трансмиссивных раков. В любом случае надо выяснять, при каких условиях они возникают, как воспроизводятся, сколько надо клеток, чтобы опухоль начала расти в новом хозяине, от чего зависит регрессия. Оснований для паники нет, но бдительность терять нельзя.
Источник: ЭЛЕМЕНТЫ БОЛЬШОЙ НАУКИ

