Исследование двух случаев меланомы показало, что неоантигены раковых клеток и инфильтрирующие опухоль Т-клетки, распознающие эти неоантигены, находятся в постоянном взаимодействии: такие Т-клетки исчезают, если исчезают соответствующие неоантигены (из-за подавления экспрессии или потери кодирующих их мутантных аллелей). Показано, что Т-клетки меняют набор опухолевых неоантигенов, заставляя опухоль избавляться от них. Это означает, что для предотвращения развития устойчивости опухолей следует применять индукцию Т-клеточного ответа сразу против нескольких неоантигенов. Исследование опубликовано в Nature.
Рис. 1. Т-лимфоцит человека. Изображение получено с помощью сканирующей электронной микроскопии.
В процессе роста опухоли и метастазирования раковые клетки постоянно мутируют. В результате мутаций в некоторых генах белки, кодируемые этими генами, могут получить участки, которые не встречаются у здоровых клеток и будут распознаваться иммунной системой организма как чужеродные — так называемые неоантигены. Недавно мы обсуждали статью, авторы которой показали, что неоантигены могут быть эффективной мишенью для иммунотерапии. Удалось искусственно, путем манипуляций in vitro, научить Т-клетки здоровых доноров распознавать неоантигены опухолевых клеток, забранных у троих пациентов. Об успешности этого метода говорить рано, но определенные надежды он дает.
Другой, хотя и близкий по духу, подход к использованию собственных ресурсов организма в борьбе с опухолью — разработанный также в последние годы метод адаптивного переноса собственных Т-клеток (autologous Аdoptive cell transfer, ACT). Пациенту вводятся его же цитотоксичные Т-клетки, выделенные из окружения раковой опухоли и без модификаций размноженные in vitro. Эти Т-клетки уже «обучены» атаковать неоантигены, поскольку произошли от клеток, которые сами этому научились. Было показано, что метод ACT имеет мощный клинический потенциал. Но до сих пор было неизвестно, остается ли постоянным набор неоантигенов при ACT. А это, естественно, нужно знать, чтобы определять перспективы продолжительного лечения этим методом.
Разобраться в этом вопросе решила группа ученых из нескольких научных учреждений Голландии и Дании. Они исследовали неоантигены, которые присутствовали в опухолях двух больных меланомой, которые на протяжении нескольких лет лечились с помощью ACT. Авторы проследили изменения экспрессии неоантигенов и их узнавания Т-клетками.
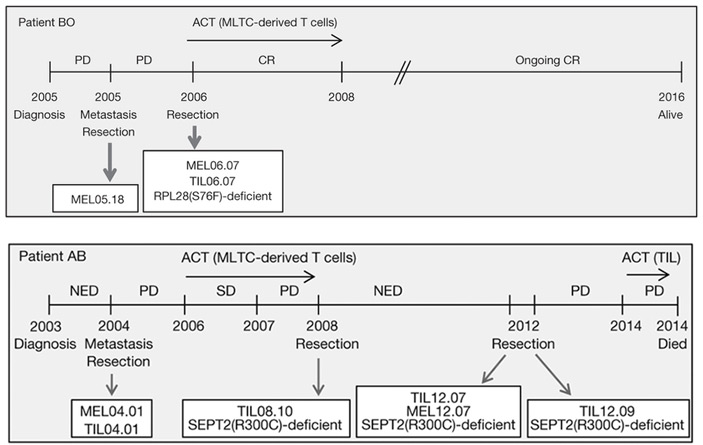
Рис. 2. Схема протекания заболевания, отбора биологического материала и лечения двух пациентов с меланомой IV стадии. PD — прогресс заболевания, CR — клиническая ремиссия, NED — нет данных о прогрессе заболевания, SD — стабилизация заболевания.
У первого больного меланомой IV стадии (обозначен ВО на рис. 2) при постановке диагноза уже наблюдалось несколько метастазов под кожу, в лимфатические узлы и в легкие. Один из подкожных метастазов был удален, и из него получили линию клеток MEL05.18, которая использовалась для характеристики исходного набора неоантигенов. В течение следующего года болезнь прогрессировала: образовались метастазы в мозге. Из одного такого метастаза была получена линия клеток MEL06.07 и культура инфильтрировавших метастаз лимфоцитов TIL06.07. Размножив эти лимфоциты, врачи начали ACT-терапию, которая оказалась весьма успешной: на протяжении более 9 лет, вплоть до момента представления работы к печати, пациент оставался в живых.
Анализ структуры генов клеток линии MEL05.18 обнаружил множество замен нуклеотидов, которые вызывали соответствующие замены аминокислот в белках. С помощью синтетических пептидов, перекрывающих эти замены, в пяти белках были определены участки узнавания для Т-клеток пациента ВО — это и были неоантигены, отсутствовавшие в нормальных тканях. Для определения стабильности набора неоантигенов, распознаваемых Т-клетками, сначала была определена реактивность Т-клеток против двух из них: белков KIA(P451L) и RPL28(S76F). Т-клетки, опознающие оба этих неоантигена, обнаруживались в крови во время взятия проб для линии MEL05.18. Эти данные использовались как исходные для прослеживания результатов лечения, изменения наборов неоантигенов и Т-клеток.
Уже через год среди лимфоцитов в линии TIL06.07 практически не былоТ-клеток, распознающих эти неоантигены. Причем и в линии MEL05.18, и в линии MEL06.07 присутствовали мутантные последовательности неоантигена KIA(P451L), а следы RPL28(S76F) из линии MEL06.07 исчезли (рис. 3).
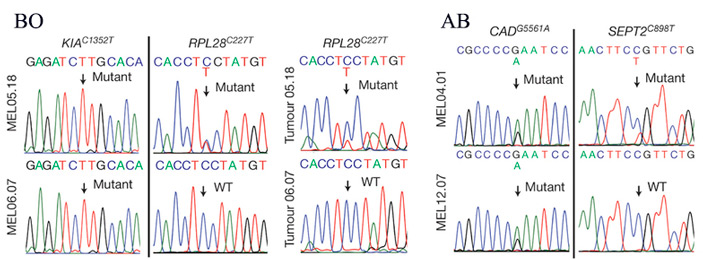
Рис. 3. Результаты анализа структуры генов в тканях опухолей и в линиях клеток пациента ВО (слева) и пациента АВ (справа). Стрелками указаны несинонимические мутации, приведшие к образованию неоантигенов, и соответствующие позиции у дикого типа (WT).
Анализ микросателлитов, локализованных вблизи RPL28, выявил делецию одной из двух копий этого гена и в MEL06.07, и в ткани опухоли, в то время как в нормальной ткани и в клетках MEL05.18 присутствовали обе копии (рис. 4).
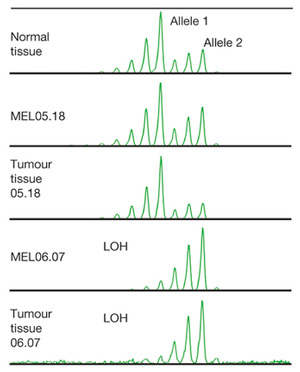
Рис. 4. Потеря гетерозиготности в области гена RLP28 в культуре клеток MEL06.07 и в ткани опухоли из пробы 06.07. В нормальной ткани обе копии гена сохранялись.
Эти данные позволили предположить, что в процессе развития заболевания действительно происходит иммуноредактирование опухоли — избавление от неоантигенов, узнаваемых цитотоксичными Т-клетками. В результате может повышаться способность опухоли противостоять действию механизмов иммунитета.
Всё это позволило предположить, что накопление в окружении опухоли Т-клеток, специфичных для неоантигена, отражает присутствие в опухолях соответствующего неоантигена. С целью проверки этого предположения была изучена экспрессия неоантигенов в ходе развития заболевания у второго пациента, которого в исследовании называли пациентом АВ. Через год после постановки диагноза из подмышечного метастаза была получена линия клеток MEL04.01 и Т-клетки TIL04.01. Болезнь прогрессировала, и через два года была начата ACT-терапия при помощи этих Т-клеток. На год болезнь стабилизировалась, но затем развились метастазы в печени. Метастазы были удалены, и из них получены лимфоциты TIL08.10. Еще четыре года прогресса заболевания не наблюдалось, но затем эффект ACT закончился и развились метастазы в легких, в костях и под кожей. Из подкожных метастазов были получены линия клеток MEL12.07, лимфоциты TIL12.07 и TIL12.09. Новый курс АСТ успеха не имел.
Анализ структуры генов клеток линии MEL04.01 выявил множество мутаций, способных привести к формированию неоантигенов. Т-клетки, которые применялись для ACT, узнавали лишь неоантигены белков EML1(R64W), SEPT2(R300C) и CAD(R1854Q) и практически не узнавали белки дикого типа. Для всех последующих линий Т-клеток, которые выделялись из метастазов пациента, наблюдался низкий уровень реактивности против белка EML1(R64W) и не наблюдалось практически никакой реактивности против белков SEPT2(R300C) и CAD(R1854Q). Против неоантигена мутантного белка программированной гибели клеток в линии TIL08.10 никакой активности не наблюдалось, но в линиях TIL12.07 и TIL12.09 она была достаточно четко выраженной. Проверка наличия нуклеотидных последовательностей неоантигенов в геномах опухолей и полученных из них культурах клеток, а также уровня экспрессии этих неоантигенов показали, что за время развития опухолей аллель SEPT2(R300C), присутствовавший в MEL04.01, в MEL12.07 был потерян. Мутантный аллель CAD(R1854Q) в соответствующих клетках сохранялся, но его экспрессия была очень сильно подавлена.
Таким образом, в ходе анализа взаимоотношений неоантигенов и реагирующих на них Т-клеток у больных меланомой, который велся на протяжении длительного времени после ACT, наблюдалось изменение уровня экспрессии четырех из шести исследованных неоантигенов. В двух случаях мутантный аллель со временем терялся, в одном случае экспрессия мутантного гена существенно подавлялась, а в одном случае она значительно усиливалась. Во всех четырех прослеженных случаях изменения экспрессии неоантигенов соответствовали изменениям активности направленных против них Т-клеток. Имеющиеся данные пока не позволяют с абсолютной достоверностью утверждать, являются ли наблюдаемые изменения следствием случайных клональных вариаций в различных метастазах или они обусловлены селекцией неоантиген-негативных вариантов под действием распознающих их Т-клеток. Но второе предположение более вероятно. Взаимоотношения между клетками раковой опухоли и Т-клетками против неоантигенов напоминают взаимоотношения между бактериями и антибиотиками, когда происходит селекция бактерий, устойчивых к антибиотику.
Полученные результаты показывают, что для предотвращения развития устойчивости опухоли к Т-лимфоцитам целесообразно индуцировать ответ не на один, а на несколько неоантигенов. Для опухоли избавиться сразу от нескольких неоантигенов труднее, чем от одного. Следует отметить, что, в соответствии с недавними результатами другой группы (авторы обсуждаемой работы о них, скорее всего, не знали), ассоциированные с опухолью Т-клетки узнают далеко не все потенциальные неоантигены. Против этих неоантигенов дополнительно может быть вызван Т-клеточный ответ, что может повысить эффективность лечения.
Источник: ЭЛЕМЕНТЫ БОЛЬШОЙ НАУКИ

