Технология CRISPR-Cas9, позволяющая редактировать геномы высших организмов, — сверхпопулярная тема обсуждений, касающихся перспективных направлений лечения многих тяжелых заболеваний, таких как ВИЧ, различные наследственные и онкозаболевания. Настоящая гонка, развернувшаяся между китайскими и американскими исследователями, ставит своей целью внедрение технологии в клиническую практику и проверку ее эффективности в лечении пациентов. Недавно Китаю удалось вырваться вперед в этом состязании, впервые произведя пациенту аутологичную трансплантацию иммунных клеток, отредактированных с помощью CRISPR-Cas9 и запрограммированных на борьбу с опухолью. Важность этого события для будущего технологий геномного редактирования в медицине специально для «биомолекулы» прокомментировал Павел Волчков — заведующий лабораторией геномной инженерии МФТИ.
Лаборатория геномной инженерии МФТИ — молодая и интенсивно развивающаяся лаборатория со многочисленными проектами и планами. Реализация большей части из них связана с использованием в качестве основного инструмента технологии CRISPR-Cas9. Одним из самых привлекательных направлений использования данной технологии является персонализированная медицина, желающая поставить себе на вооружение метод высокоточного геномного редактирования для борьбы со многими тяжелыми наследственными заболеваниями или злокачественными опухолями. Молекулярная технология CRISPR-Cas9 успешнее других претендует на роль этого универсального оружия, и первые шаги по ее применению к реальным пациентам подобны первым полевым испытаниям.
Заведующий лабораторией — Павел Волчков — прокомментировал некоторые из громких открытий и разработок в этой области. Но сначала расскажем подробнее, о чем же речь.
Откуда мы знаем про CRISPR-Cas9?
В качестве высокоточного инструмента редактирования ДНК технология CRISPR-Cas9 была разработана в 2012–2013 годах. Однако знакомство исследователей с молекулярным механизмом, ставшим основой «умных ножниц для ДНК», случилось гораздо раньше и было обязано бактериям, а именно защитному механизму, позволяющему им выходить победителями из встречи с вирусами и другими патогенами.
В основе этого механизма лежат особые участки генома — CRISPR, обнаруженные впервые в 1987 году Ёсидзуми Исино у кишечной палочки (Escherichia coli) и представляющие собой одинаковые повторяющиеся последовательности (CRISPR, clustered regularly interspaced short palindromic repeats), чередующиеся с уникальными участками (спейсерами). Эти уникальные последовательности — «фотоальбом», в котором бактерия хранит «фотографии» всех патогенов, ранее встреченных ею или ее предками. Благодаря этим «фотографиям» при будущих встречах с данными патогенами бактерия имеет высокие шансы вовремя распознать их и обезоружить. Помогают ей в этом специальные комплексы белков Cas, ассоциированные в геноме с CRISPR-локусами и участвующие в уничтожении чужеродного генетического материала, а также помогающие добавлять и запоминать фотографии новых патогенов, попадающих в клетку. Осуществляется это запоминание за счет вырезания характерного для данного патогена участка ДНК и встраивания его в виде нового спейсера в геном бактерии.
Превращение механизма бактериального иммунитета в инструмент редактирования геномов высших организмов потребовало решения ряда сложных задач, связанных, главным образом, с повышением точности определения участка ДНК, который распознается и вырезается комплексом белка Cas9 со специальной молекулой РНК, служащей для белка гидом к этому участку. Однако труды генных инженеров увенчались успехом и уже к 2013 году позволили создать удобный способ доставки молекулярного комплекса CRISPR-Cas9, который был опробован на культуре человеческих клеток. Будучи успешно испытанной на клетках многих модельных организмов и доказав свою эффективность на этой стадии, технология CRISPR-Cas9 приковала всеобщее внимание как перспективный инструмент в клинической практике для лечения многих заболеваний, включая наследственные и онкозаболевания. На настоящий момент развитие технологии вплотную подошло к проверке ее эффективности в клинических испытаниях.
Первый рывок в гонке клинических испытаний CRISPR-Cas
О подготовке к проведению клинических испытаний технологии CRISPR-Cas9 заявили сразу две исследовательские группы — из Китая и США. В этой биомедицинской гонке, прозванной с легкой руки американского иммунолога Карла Джуна «Спутник 2.0», китайской группе удалось вырваться вперед на самом старте, впервые сделав пациенту инъекцию, содержащую его собственные иммунные клетки, отредактированные с помощью CRISPR-Cas9 для борьбы с агрессивным раком легких. Исследователи отобрали Т-лимфоциты пациента и вырезали в них ген, кодирующий белок PD-1 (Programmed cell death 1), затормаживающий иммунный ответ и дающий опухолевым клеткам возможность избежать инактивации, уходя из-под надзора иммунной системы. После редактирования клетки с измененным геномом культивировали в присутствии цитокинов, а затем инъекционно вводили обратно пациенту с расчетом на то, что отредактированные клетки будут эффективнее уничтожать клетки опухоли. Данный подход представляет собой редактирование клеток пациента ex vivo и является одним из возможных для использования в терапии (рис 1). Стоит отметить, что ингибирование PD-1 — уже устоявшийся подход в иммунотерапии многих опухолевых заболеваний. На настоящий момент зарегистрировано более 170 клинических испытаний, направленных на проверку новых ингибиторов PD-1.
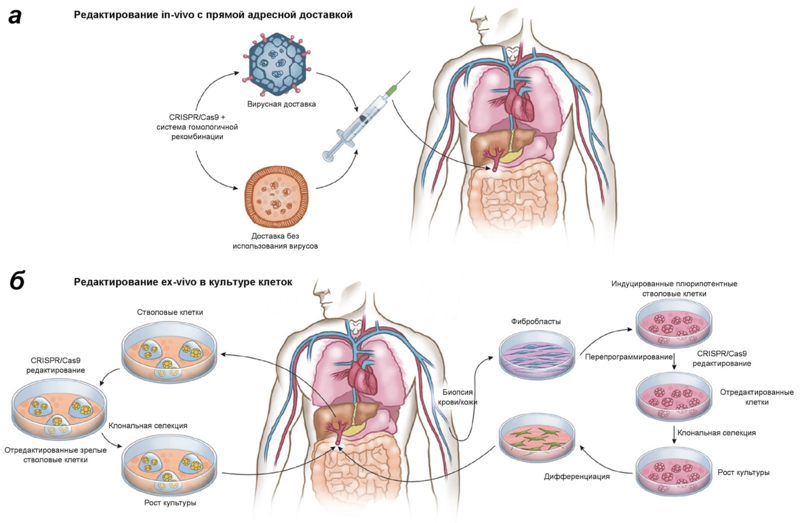 Рисунок 1. In vivo и ex vivo подходы к использованию CRISPR-Cas9 в генной терапии. Китайские исследователи использовали ex vivo подход к редактированию клеток пациента. Однако он — лишь один из двух возможных вариантов лечения патологий с помощью CRISPR-Cas9. а — In vivo CRISPR-Cas9-система доставляется прямо в организм пациента с использованием специальных векторов вирусного или не вирусного происхождения и позволяет произвести редактирование в организме самого пациента. б — Ex vivo редактированию с помощью CRISPR-Cas9 подвергаются, например, соматические стволовые или прогениторные клетки, которые были первоначально взяты у пациента. После редактирования клетки с измененным геномом отбирают, растят в культуре и трансплантируют (инъецируют) обратно пациенту.
Рисунок 1. In vivo и ex vivo подходы к использованию CRISPR-Cas9 в генной терапии. Китайские исследователи использовали ex vivo подход к редактированию клеток пациента. Однако он — лишь один из двух возможных вариантов лечения патологий с помощью CRISPR-Cas9. а — In vivo CRISPR-Cas9-система доставляется прямо в организм пациента с использованием специальных векторов вирусного или не вирусного происхождения и позволяет произвести редактирование в организме самого пациента. б — Ex vivo редактированию с помощью CRISPR-Cas9 подвергаются, например, соматические стволовые или прогениторные клетки, которые были первоначально взяты у пациента. После редактирования клетки с измененным геномом отбирают, растят в культуре и трансплантируют (инъецируют) обратно пациенту.
Детальные результаты проведенного китайскими исследователями испытания пока не сообщаются, однако уже заявлено, что пациенту была произведена вторая инъекция. Также авторы поделились своими планами по проведению дальнейших испытаний с участием еще 10 пациентов. Каждому из них планируется произвести от двух до четырех инъекций, а затем всех будут тщательно наблюдать в течение последующих шести месяцев для выявления возможных серьезных негативных последствий. Независимо от первого успеха китайских коллег, американские исследователи еще в июле заявили о готовности развернуть в 2017 году масштабные клинические испытания с использованием CRISPR-Cas9 против рака простаты, почек и мочевого пузыря. Старт запланирован на начало 2017 года.
Уникальна ли CRISPR-Cas в качестве технологии геномного редактирования?
Несмотря на явное преимущество по уровню информационного освещения, технология CRISPR-Cas9 не является единственной технологией редактирования ДНК, которая может использоваться для лечения реальных заболеваний.
В 2014 году американские исследователи впервые провели испытания технологии с использованием ферментов, имеющих домены «цинковые пальцы» (Zinc-finger nucleases, ZFNs), на пациентах с ВИЧ. Испытания проводили на 12 пациентах с целью избавить иммунные клетки от гена ССR5, уменьшающего их резистентность к ВИЧ. Исследователи постарались вырезать этот ген в Т-лимфоцитах, поскольку белок ССR5 служит для вируса в качестве «пропускного пункта» в эти клетки, и люди, имеющие мутации в гене ССR5, обладают устойчивостью к ВИЧ. В данных испытаниях иммунные клетки подверглись редактированию ex vivo, в ходе которого они были выделены из крови пациентов и отредактированы с использованием коммерчески доступных нуклеаз с «цинковыми пальцами».
Однако эффективность редактирования оказалась невысокой — только в 25% клеток редактирование нужного гена прошло успешно. Тем не менее после инъекции редактированных клеток в прогнозе пациентов были отмечены позитивные изменения — у всех 12 человек после прекращения антиретровирусной терапии уровень ВИЧ восстанавливался гораздо медленнее, чем в норме, а уровень Т-лимфоцитов оставался достаточно высоким в течение нескольких недель. Интересно, что у одного из пациентов уровень вируса не восстанавливался в течение целых 12 недель после остановки терапии. Авторы, исследовав геном пациента, обнаружили, что он имеет одну мутировавшую копию гена CCR5, что, по всей видимости, и позволило ему лучше сопротивляться вирусу по сравнению с другими пациентами. Несмотря на достигнутые положительные результаты, испытание данной технологии выявило ряд сложностей, делающих их использование в терапии затруднительным. Во-первых, это недостаточная точность редактирования ДНК в клетках пациентов. Во-вторых, в ходе испытания у пациентов отмечались некоторые малоприятные побочные эффекты, вызванные инъекцией. Например, не исчезающий в течение нескольких дней ужасный запах, исходящий от тел пациентов, возникающий вследствие метаболизма диметилсульфоксида (ДМСО), который используется в качестве криоконсерванта для клеточной культуры.
Однако последующие работы исследователей позволили улучшить технологию использования нуклеаз с «цинковыми пальцами», и на сегодняшний день компания Sangamo, впервые применившая ее для лечения пациентов, уже провела испытания на 80 пациентах и получила более обнадеживающие результаты.
Вторым видом технологии геномного редактирования стало использование фермента TALEN (Transcription activator-like effector nuclease) для спасения маленькой однолетней пациентки с лейкемией в Британии. Испытать подобную технологию авторы исследования решились после того, как все остальные способы лечения ребенка потерпели неудачу. Исследователи использовали Т-лимфоциты, взятые у здорового донора, повысив их устойчивость к противоопухолевым препаратам и модифицировав с помощью технологии UCART (Universal Chimeric Antigene Receptor T-cells), позволяющей им атаковать опухолевые клетки, но не причинять вреда здоровым клеткам пациентки. Авторы признались, что инъекция подобных иммунных клеток с редактированной ДНК не позволяет однозначно вылечить заболевание, однако у пациента появляется шанс дождаться подходящего донора костного мозга. И в данном случае такой донор был найден. Модифицированные иммунные клетки позволили организму девочки побороть опухолевые клетки, а трансплантация — восстановить иммунную систему, сильно пострадавшую в ходе курса химиотерапии и борьбы с опухолью. Случай выздоровления юной пациентки получил широкий общественный резонанс и позволил технологиям редактирования генетической информации еще на шаг приблизиться к применению в клинической практике.
Комментарий Павла Волчкова, заведующего лабораторией геномной инженерии МФТИ

http://biomolecula.ru/img/content/2076/01.ispolzovanie-CRISPR-Cas9.pngРисунок 2. Павел Юрьевич Волчков, заведующий лабораторией геномной инженерии МФТИ
Первые шаги в виде первых клинических испытаний очень важны для внедрения технологии в клиническую практику. Они хорошо привлекают общественное внимание, что в свою очередь довольно хорошо стимулирует скорость интеграции технологии, а также увеличивает количество сопряженных разработок и позволяет привлечь дополнительное финансирование. Если смотреть на историю развития подходов к редактированию генома, то, начиная с 90-х годов, она будет идти плавно и поступательно с небольшими пиками, соответствующими тем или иным громким событиям, например, попыткам применения определенной технологии на пациентах. В 2014 и 2015 годах такими событиями стали первые применения ZNFs и TALEN для лечения пациентов с ВИЧ и лейкемией соответственно.
Сейчас мы наблюдаем, пожалуй, самый большой из пиков, и связан он с развитием системы CRISPR-Cas9. Если сравнивать интерес к применению всех трех технологий и расположить его на определенном ландшафте, то пик, происходящий сейчас с CRISPR-Cas9, это еще не «Гималаи», но уже как минимум «Альпы». Важно также понимать, что переход между этими «высотами» связан с нашими ожиданиями от технологии, а они имеют колебательный характер — интерес к продукту растет соответственно ее громким успехам и падает, если ожидания этих успехов сильно затягиваются. Примерно по такому же принципу изменяется и финансирование разработки технологии. В конечном итоге судьба каждого успешного продукта — это выйти на определенное плато, где компании, выпускающие его, начинают получать максимальную выгоду.
Если искать причины, почему именно CRISPR-Cas9 вызвал наибольший ажиотаж вокруг технологий редактирования генома, то стоит отметить следующие вещи. Во-первых, весь этот информационный бум был, действительно, хорошо сгенерирован. А во-вторых, технология CRISPR-Cas9 хороша благодаря своей исключительной универсальности. Она позволяет получить нуклеазу нужной вам специфичности в минимально короткое время по сравнению с ZNFs и TALEN. Это довольно сильное преимущество, поскольку специфичность и эффективность ферментов из всех трех технологий практически одинакова. Sangamo, пионеры в области создания нуклеаз «цинковых пальцев», оттачивали их дизайн десятилетиями, так что их специфичность ничуть не уступает другим нуклеазам. Однако здесь и кроется отличительная черта CRISPR-Cas9 — это возможность максимально быстро преодолевать стадию дизайна, практически в один шаг. Вы имеете возможность быстро создать десяток молекул-гидов для нуклеазы Cas9 и проверить их эффективность и специфичность на нужном вам участке ДНК. Дальнейшая доработка технологии примерно одинакова во всех трех случаях — это определения способа доставки системы в нужные клетки, проработка клинической составляющей и других сопутствующих технологий.
Важно понимать, что сам молекулярный механизм, производящий редактирование ДНК, это важная составляющая будущего клинического продукта, но одной ее недостаточно для того, чтобы лечить пациентов. В список сопутствующих технологий, необходимых для использования геномного редактирования в терапии, входят методы культивирования клеток, которые предполагается редактировать (например, Т-клетки иммунной системы), а также технологии доставки редактирующей молекулярной системы (например, использование вирусных векторов). Кроме того, развитие технологий геномного редактирования толкает вперед развитие приборостроения, поскольку машин, которые автоматически выполняли ли бы всю работу, связанную, например, с отобранными клетками, в клинике сейчас нет. Однако такие машины просто необходимы, поскольку нам важны время и автоматизация процесса для эффективной терапии.
Что же касается заболеваний, в лечении которых планируется попробовать использовать CRISPR-Cas9, то их список достаточно обширен. Editas — одна из крупнейших и многообещающих компаний, разрабатывающих клинические продукты на основе CRISPR-Cas9, — решила сфокусировать свое внимание на заболеваниях, лечение для которых на настоящий момент практически отсутствует или является недостаточно эффективным.
Основные клинические направления, которые Editas выбрала для исследований, можно разделить на три группы.
- Редкие генетические заболевания, такие как амавроз Лебера или синдром Ушера, которые встречаются у одного человека из нескольких десятков тысяч, и для которых на настоящий момент нет лечения. Интересно, что для амавроза Лебера в 2008 году успешно был опробован способ доставки с помощью аденовирусов (ААV), которые сейчас являются одними из самых популярных векторов в генной терапии.
- Тяжелые генетические заболевания крови, мышц, легких и печени, для большинства из которых существуют способы только симптоматического лечения, например, муковисцидоз и миодистрофия Дюшенна. В качестве способа доставки помимо аденовирусов для них планируется использовать рибонуклеопротеины (ribonucleoproteins, RNP) и липидные наночастицы (lipid nanoparticles, LNP).
- Опухолевые заболевания, для борьбы с которыми компания Juno Therapeutics предлагает модифицировать Т-клетки самих онкопациентов ex vivo, «обучая» их лучше расправляться с опухолевыми клетками.
В дополнительную группу также можно выделить инфекционные заболевания, например, герпетическое поражение глаз, для которых существуют методы лечения, однако они недостаточно эффективны или подразумевают сильное хирургическое вмешательство.
Для всех групп заболеваний в качестве корректирующего механизма Editas планирует использовать технологии, основанные на разных способах репарации ДНК после ее разрезания Cas9. Эти технологии включают в себя такие механизмы репарации, как негомологичное соединение концов (non-homologous end joining, NHEJ) и гомологичную рекомбинацию (homology directed repair, HDR).
Старт клинических испытаний намечен на 2017 год, и Editas — не единственная компания, заявившая о них. Подобные схемы будущих испытаний уже предложили другие крупные компании — Intellia Therapeutics и Crispr Therapeutics.
Никто не застрахован от ошибок
Несмотря на громкий успех китайских исследователей, менее чем через неделю это событие оказалось омрачено печальной новостью из США. В ходе клинический испытаний, проводимых компанией Juno Therapeutics по редактированию Т-лимфоцитов пациентов с острым лимфобластным лейкозом, двое пациентов скончались по причине проявившихся осложнений после трансплантации редактированных клеток. На данный момент FDA — Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration) — приостановило испытания до полного выяснения обстоятельств и причин гибели пациентов. Некоторые эксперты предполагают, что данный прецедент может серьезно ограничить Juno в дальнейших разработках технологии CAR (chimeric antigen receptor) для модификации иммунных клеток онкопациентов.
Случившиеся последовательно успех и неудача использования CRISPR-Cas9 в клинических испытаниях — хороший пример того, насколько сложен путь вхождения технологий геномного редактирования в практику для лечения реальных пациентов. Отбросив весь информационный шум, объективно можно сказать, что говорить об эффективности технологии, а главное о ее безопасности — довольно рано. Пока у нас нет данных успешных клинических испытаний с участием большого числа пациентов, ажиотаж вокруг развивающейся генной терапии будет подкрепляться исключительно общественными ожиданиями, но никак не реальными клиническими показателями. Тем не менее наши ожидания от технологий геномного редактирования огромны, и на настоящий момент представить ближайшее будущее без этих технологий довольно сложно (см. видео).
Источник: БИОМОЛЕКУЛА

