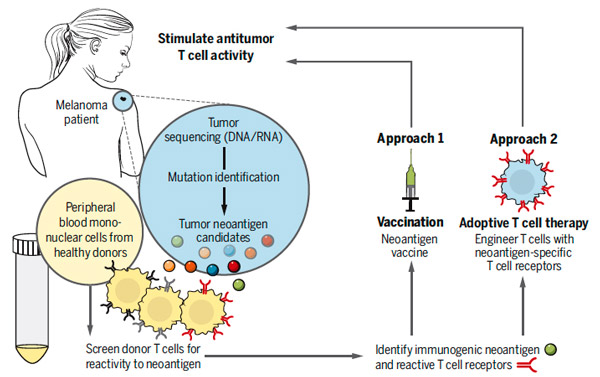
Рис. 1. Схема исследования. Генетический материал клеток опухоли секвенируют и определяют произошедшие с ними мутации. Исходя из этой информации определяются наиболее вероятные кандидаты в хорошо работающие антигены. На эти антигены ученые пытаются «настроить» Т-клетки здорового донора, после чего проверяют успешность этой настройки по активности Т-клеток по отношению к клеткам опухоли in vitro. Если неоантигены хорошо себя зарекомендовали, то на их основе можно изготовить вакцины. Кроме того, больной раком может получить свои же Т-клетки, которые специально «обучены» бороться с его болезнью.
Один из перспективных подходов к лечению рака — применение Т-клеток, реагирующих на новые антигены, которые возникают вследствие мутаций в генах опухолей. Проблема в том, что лишь малая доля этих неоантигенов распознается собственными Т-клетками больного. Ученые отобрали из клеток трех пациентов, больных меланомой, несколько десятков потенциальных антигенов. С помощью манипуляций in vitro им удалось научить Т-клетки, взятые у здоровых доноров, нападать на 11 из 57 антигенов. Такой «иммунный ответ извне» открывает новые возможности для усовершенствования иммунотерапии рака.
В генах раковых клеток происходят сотни мутаций. В результате в белках, кодируемых этими генами, могут образовываться новые эпитопы, или антигенные детерминанты, — участки белков, которые узнаются иммунной системой (антителами или Т-клетками). В последнее время появляется все больше данных о том, что эти новые антигены — неоантигены — можно использовать как мишени для иммунотерапии рака, атакуя их (и, следовательно, раковые опухоли) специфическими Т-клетками — основным компонентом клеточного иммунитета.
Однако противоопухолевому Т-клеточному ответу препятствует микроокружение опухоли (tumor microenvironment). Оно не только мешает доступу Т-клеток к опухоли, но и вызывает толерантность иммунной системы, предотвращая формирование противоопухолевых Т-клеток. По имеющимся к настоящему времени данным, в организме больных раком пациентов лишь менее 1% мутаций оказываются иммуногенными, то есть способными вызвать реакцию иммунной системы. Остальные мутации либо не приводят к образованию новых антигенов, либо их проявлению препятствуют защитные механизмы опухоли.
Группа исследователей из научных учреждений Норвегии, Дании и Голландии поставила перед собой задачу разобраться с тем, какие именно из сотен раковых мутаций приводят к формированию иммуногенных неоантигенов. Результаты их работы опубликованы в журнале Science. Ученые провели полное секвенирование экзомов и мРНК из клеток меланомы IV стадии трех пациентов и определили мутации в ДНК-последовательностях, кодирующих белки (рис. 2).
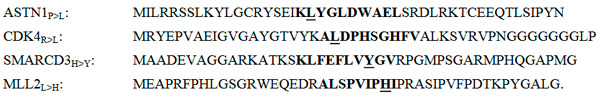
Рис. 2. Фрагменты аминокислотных последовательностей четырех мутантных белков раковой опухоли одного из пациентов (аминокислотные остатки обозначены латинскими буквами). Индексами обозначены мутации. Например, в белке ASTN1P>L произошла замена пролина на лейцин. Жирным выделены последовательности, закодированные в мРНК и экспрессированные в дендритных клетках как неоантигены. Подчеркнуты «раковые» аминокислотные остатки.
Из 249 кандидатов в неоантигены с помощью компьютерного анализа было отобрано 126 пептидов (эпитопы для Т-клеток обычно представляют собой пептиды), от которых ученые ожидали способность взаимодействовать с главным комплексом гистосовместимости класса I (major histocompatibility complex class I, MHC-I) и, таким образом, способность распознаваться Т-клетками. Формирование комплекса из антигена и MHC-I необходимо для того, чтобы дендритные клетки связывались с Т-клетками и «инструктировали» их против антигенов (рис. 3). Из 126 пептидов только два были распознаны Т-клетками, выделенными из окружения тех же опухолей, из которых были отобраны эти пептиды.
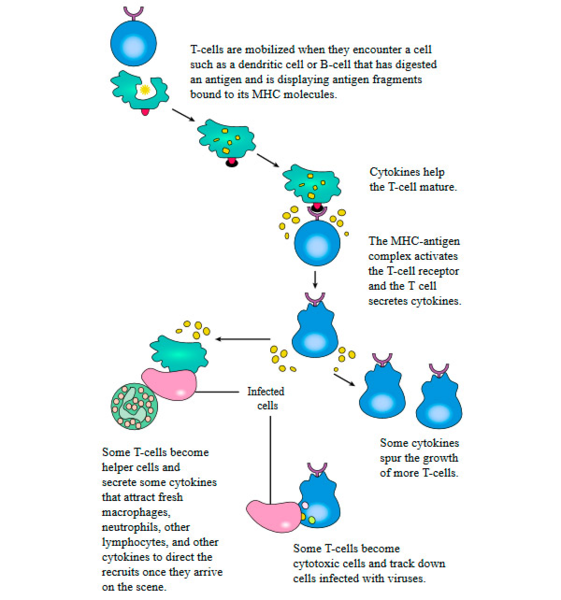
Рис. 3. Общая схема активации и функционирования Т-клеток. В обсуждаемой работе ученые немного вмешались в этот алгоритм: неоантигены не поглощались дендритными клетками, а синтезировались под контролем введенных в них мРНК; затем активированные Т-клетки атаковали in vitro раковые клетки в культуре.
Тогда ученые решили выяснить, насколько хорошо отобранные эпитопы будут узнаваться иммунной системой здоровых доноров. Были отобраны кандидаты в неопептиды с наиболее высокой предсказанной способностью связываться с MHC-I. Для этого клетки из крови каждого донора культивировались совместно с дендритными клетками этого донора, в которые были введены мРНК, кодирующие соответствующие неопептиды одного из пациентов. Из 20 испытанных неоантигенов первого пациента цитотоксичные Т-клетки формировались против пяти (рис. 4). Остальные, вероятно, оказались недостаточно сильными антигенами. Аналогичные результаты были получены и для неопептидов двух других пациентов. Всего из 57 испытанных неопептидов 11 оказались способными индуцировать формирование специфических Т-клеток (как мы помним, Т-клетки, выделенные из окружения опухолей пациентов, оказались способными узнавать только два из них). Следовательно, иммуногенных мутаций и неоантигенов, против которых может развиться иммунный ответ, намного больше, чем считалось до сих пор, и опухоли имеют гораздо более сильный иммуногенный потенциал.
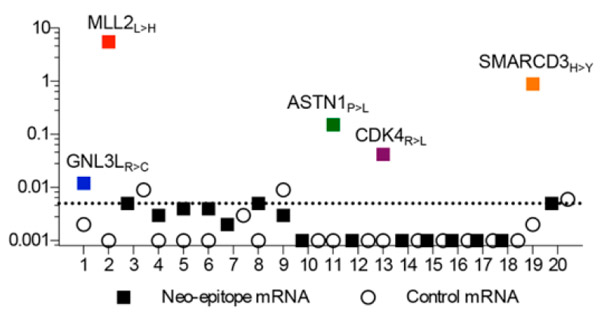
Рис. 4. Доля Т-клеток (в процентах), активированных in vitro против 20 потенциальных неоантигенов одного из пациентов.
Биологическая активность Т-клеток здоровых доноров, индуцированная неоантигенами, была исследована на культурах клеток опухолей от соответствующих пациентов. Т-клетки активно узнавали и убивали опухолевые клетки.
Возникает важный вопрос: почему спектр специфичности Т-клеток, полученных с помощью неоантигенов из лейкоцитов здоровых доноров, значительно шире, чем у больных раком? Авторы почему-то не представили данных о спектре специфичности антираковых Т-клеток из крови больных. Это помогло бы понять, с чем связан дефицит таких клеток в организме: с их неспособностью образовываться in vivo или с развитием в организме толерантности к опухоли.
Чтобы установить, связана ли приобретенная противоопухолевая активность Т-клеток здоровых доноров с приобретением рецепторов неоантигенов, авторы секвенировали геномы 28 клонов таких цитотоксических клеток и определили нуклеотидные последовательности рецепторов. Затем гены рецепторов были реконструированы и введены в новые Т-клетки. В результате эти Т-клетки приобретали способность реагировать на соответствующие эпитопы неоантигенов и вызывать гибель опухолевых клеток in vitro.
Результаты обсуждаемой работы открывают новые перспективы для усовершенствования иммунотерапии рака. Так, ранее было уже показано, что иммунизация неоантигенами усиливает иммунный ответ против меланомы. Разработанный авторами обсуждаемой работы метод оценки потенциальной эффективности неоантигенов позволит более успешно подбирать пептиды — кандидаты для прямой вакцинации (рис. 1). Альтернативным подходом может быть прямое введение больным цитотоксических Т-клеток, запрограммированных против конкретных неоантигенов. Такие Т-клетки можно получать in vitro не только на основе лейкоцитов здоровых доноров, как делали авторы, но и из лейкоцитов пациента.
В последнее время вообще наблюдается существенный прогресс в разработке иммунотерапевтических методов лечения рака с помощью раковых антигенов. Общая цель этих исследований — заставить иммунную систему больного бороться с клетками своего же организма, которые утратили полезные функции и превратились в клетки опухоли. Недавно, например, мы обсуждали довольно успешную попытку доставки специфических маркеров опухолей прямо в дендритные клетки. В отличие от обсуждаемой работы, в которой авторы ограничились экспериментами лишь на культурах клеток, в том исследовании была показана эффективность на экспериментальных животных и даже на пациентах больных раком.
Подходы, предлагаемые в обеих работах, имеют свои достоинства и недостатки. В упомянутой июльской новости ученые оперируют белками, характерными для раковых клеток и отсутствующими в нормальной зрелой ткани. Эти белки, однако, играют свою определенную роль в онтогенезе и дифференцировке клеток, и атака на них может иметь побочные негативные последствия. В этом отношении неопептиды из обсуждаемой работы, свойственные исключительно раковым клеткам, более предпочтительны. В то же время методика адресной доставки мРНК, кодирующих белки-индукторы противоракового ответа в производящие Т-клетки ткани, делает необязательными манипуляции с лимфоцитами in vitro, которые применялись в обсуждаемой работе. Вызов собственного иммунного ответа представляется более «естественным» и менее затратным методом. К тому же чужеродные Т-клетки, использованные в обсуждаемой работе, могут вызывать и аллергические реакции. Поэтому вполне возможно, что скоро будет освоен комбинированный подход: активация собственного иммунного ответа с помощью адресной доставки мРНК неоантигенов в лимфатические ткани и дендритные клетки для формирования противораковых Т-клеток.
Источник: ЭЛЕМЕНТЫ БОЛЬШОЙ НАУКИ

