Первая половина 2016 года принесла две интересных новости о голых землекопах — как водится, плохую и хорошую. Выяснилось, что злокачественные новообразования изредка, но всё же поражают этих грызунов-долгожителей. Что, однако, не опровергает факта их феноменальной устойчивости к раку. В объяснении механизмов этой устойчивости как раз и преуспели ученые. Оказалось, что индуцированные плюрипотентные стволовые клетки землекопов, в отличие от мышиных и человеческих, не провоцируют рост опухолей. И всего из-за двух генетических особенностей. Манипуляции с парой «враждующих» генов — подавляющим и, наоборот, стимулирующим онкогенез — подвели биологов к открытию специфичного для землекопов механизма клеточного старения и к возможности преодоления главной проблемы клеточной терапии человека.
Небольшой африканский эусоциальный зверек со смешным названием голый землекоп (англ. naked mole-rat) прославился благодаря беспрецедентной для грызунов продолжительности жизни, невосприимчивости к раку и ряду уникальных физиологических и биохимических особенностей. О возможных причинах жизнестойкости этих подземных зверьков и их почти таких же удачливых родственников «биомолекула» подробно рассказывала. До 2016 года не наблюдали ни одного случая развития злокачественных новообразований у землекопов. Но время и дотошность биологов сделали свое дело.
Онкопатология у голого землекопа: первые истории болезни
В февральском номере Veterinary Pathology появилось сообщение о двух подтвержденных случаях рака у землекопов из американских зоопарков — Брукфилдского и Национального. Опухоли разной природы обнаружили у пожилых (старше 20 лет) самцов-рабочих.
В первом случае бессимптомное подвижное 1,5-сантиметровое новообразование извлекли из подмышечной впадины. На основе цитологических, гистохимических, иммуногистохимических и ультраструктурных характеристик опухоль классифицировали как недифференцированную аденокарциному неясного происхождения — из эпителиальных клеток то ли молочных, то ли слюнных желез, хотя вариант метастаза иной опухоли тоже не исключили. Количество митозов в образцах в основном не превышало 0–1 в поле зрения (при 400-кратном увеличении) и лишь местами достигало 4. Локальную инвазию оценить не удалось, поскольку зона трансформации доходила до границ извлеченной ткани. Однако через три месяца после операции в подмышечной впадине зверька наблюдалось лишь нормальное рубцевание — никаких признаков рецидива. Оценить влияние опухоли на самочувствие и продолжительность жизни землекопа не довелось: что до, что после операции его здоровье и социальная адаптация не страдали.
А вот второй случай вряд ли можно назвать бессимптомным, хотя рак выявили уже посмертно: зверька пришлось усыпить из-за неизлечимого тяжелого дерматита и прогрессирующей потери веса. Не исключено, что обнаруженная при вскрытии желудка нейроэндокринная карцинома (устаревшее название — карциноид) могла спровоцировать подобную симптоматику. Происходит такая опухоль из энтерохромаффиноподобных_клеток, секретирующих гистамин. У усыпленного землекопа раковые клетки проникли в слизистую и подслизистую оболочки стенки желудка, местами — в мышечный слой и даже в прилегающие тонкостенные сосуды (видимо, лимфатические), однако отличались низкой митотической активностью и метастазов не сформировали.
Ранее в той же колонии землекопов Брукфилдского зоопарка уже четыре раза фиксировали гиперпластические изменения. Все находки были случайными: разрастания тканей обнаруживали при вскрытии усыпленных по иным причинам особей (эти зверьки, например, могут серьезно травмироваться в семейных стычках). В отличие от тех, судя по всему, доброкачественных образований, два новых случая неоплазии не оставили сомнений в том, что у голых землекопов может развиваться рак. Другой вопрос, что происходит это феноменально редко. И было бы странным, если бы многолетние и целенаправленные наблюдения никогда не выявили бы рака у этого вида — это же не гидры какие-нибудь, а самые настоящие млекопитающие. Нельзя исключить и особую предрасположенность конкретных колоний к неоплазии: ведь в размножении участвуют единичные особи, и вполне вероятно закрепление в популяции каких-то редких мутаций.
Авторы статьи обращают внимание читателей на то, что выявленные случаи никак не опровергают факта выдающейся невосприимчивости голых землекопов к раку. Зато тщательный анализ этих случаев необходим для разработки критериев диагностики доброкачественных и злокачественных опухолей и предраковых состояний у этого вида животных, который всё чаще используют в качестве модельного биогеронтологи и онкологи. И используют, между прочим, успешно.
Полезные «настройки» землекопа: стволовые клетки с сюрпризом
Ранее группа исследователей из США показала, что к противораковой защите землекопов может иметь отношение специфичная для этого вида экстремально высокомолекулярная гиалуроновая кислота, да не просто она, а особенности «гиалуронового» сигналинга, и в частности конечного его этапа — индукции генетического локуса INK4. Этот локус кодирует у ряда животных (и человека тоже) опухолевые супрессоры p15Ink4b, Arf и p16Ink4a, а у голого землекопа еще и уникальный дополнительный продукт — гибрид p15Ink4b и p16Ink4a, названный pALTInk4a/b. Синтез последнего индуцируется при разных стрессовых воздействиях и в процессе раннего контактного торможения клеточного деления, потому-то фибробласты землекопа в культуре осторожничают, прекращая деление при малейшем контакте с соседями и предотвращая тем самым опухолеобразование. Не удивительно, что локус INK4 (он же — CDKN2A) очень часто мутирует при раке у людей, а кроме того, участвует в развитии некоторых типов старения.
И вот, этот локус вновь привлек внимание биологов, но уже японских. Главным фигурантом нового дела стал другой его продукт, Arf (alternate reading frame protein), вышли на который довольно неожиданным путем — при манипуляциях с индуцированными плюрипотентными стволовыми клетками (ИПСК) землекопа.
Как неоднократно рассказывала «биомолекула», производство таких клеток, то есть перепрограммирование соматических клеток в дедифференцированные, напоминающие эмбриональные стволовые клетки, может быть крайне полезным и для терапии множества патологий, и для исследовательских целей. Однако такое перепрограммирование требует временной экспрессии «онкогенного коктейля» — генов Oct3/4, Sox2, Klf4 и c-Myc (OSKM), кодирующих транскрипционные факторы. Их активность сближает процесс создания ИПСК с онкогенезом: в клетках синонимично меняется экспрессия генов, эпигенетический профиль и метаболизм. Подобно эмбриональным стволовым клеткам, ИПСК, даже кратковременно экспрессирующие этот «коктейль» in vivo, могут провоцировать формирование опухолей, чаще всего тератом. Причем процесс опухолевой трансформации даже не требует каких-то мутаций, достаточно изменения профиля метилирования ДНК. Риск развития опухолей препятствует введению клеточной терапии в клиническую практику, потому способы снижения этого риска ищут в совершенно разных направлениях: и в модификации состава перепрограммирующих факторов, и в принуждении к гибели неспособных к полной дифференцировке ИПСК, и во внутренних резервах этих клеток.
Японские исследователи решили проверить, способны ли к перепрограммированию и образованию опухолей клетки животных, устойчивых к раку. Кожные фибробласты голого землекопа подошли как нельзя лучше. Оказалось, что получить ИПСК из них вполне возможно с помощью ретровирусных векторов, временно экспрессирующих мышиный OSKM-коктейль. Однако, как ни странно, эти ИПСК, в отличие от мышиных и человеческих, после пересадки в яички иммунодефицитных мышей не формировали тератом (рис. 1).
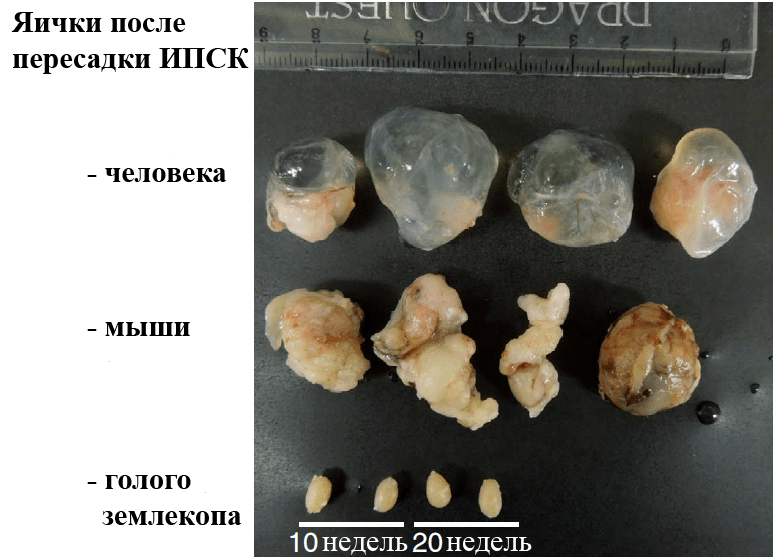
Рисунок 1. Яички иммунодефицитных мышей или их опухоли после трансплантации ИПСК разного происхождения. Сверху вниз: человека (через 10 недель), мыши (через 4 недели) и голого землекопа (через 10 и 20 недель).
Чтобы выяснить, какие факторы отвечают за онкогенность стволовых клеток, а какие препятствуют этому у ИПСК землекопа, ученые проанализировали транскрипционный профиль клеток (используя секвенирование РНК и количественную ПЦР в реальном времени). В итоге выявили две существенных особенности ИПСК землекопа.
Активный продолжительный синтез одного из продуктов локуса INK4 — Arf (он же — p19Arf у мышей и p14Arf у людей), способствующего предотвращению избыточного клеточного деления: он стабилизирует контролера клеточного цикла p53, блокируя уничтожающий его фермент Mdm2. Как известно, p53 действует через активацию синтеза p21 (этот белок участвует в дифференцировке клеток и способен ингибировать их деление даже без «приказа» p53) — и словно в подтверждение, ИПСК землекопа показали необычную активность его гена. В человеческих же и мышиных клетках синтез продуктов локуса INK4 прекращался уже на ранних стадиях перепрограммирования. Боле того, в другом исследовании было показано, что белки Arf и p16Ink4a у землекопа короче, чем у людей и мышей, и они надежно блокируют клеточный цикл фибробластов в ответ на стрессы.
«Молчание» гена ERas, фактора онкогенности мышиных стволовых клеток, действующего через активацию пути PI3K/AKT и принадлежащего к печально известному Ras-семейству. Как выяснилось, это молчание связано не с какими-то регуляторными моментами, а с банальной мутацией, привнесшей в ген ERas землекопа преждевременный стоп-кодон, а значит, определившей синтез неполноценного «белка-вредителя».
Интересно, что обе особенности имеют прямое отношение к сигнальным путям, выбранным в качестве возможных мишеней для продляющей жизнь терапии.
Но чтобы подтвердить причастность обеих находок к потрясающей онкорезистентности ИПСК землекопа, пришлось заставить замолчать их ген Arf и компенсировать дефектный ERas рабочим, мышиным. Это привело к подавлению синтеза p21 и индукции AKT-пути соответственно. Специальный тест на рост в мягком агаре и пересадка таких модифицированных ИПСК в яички мышей показали, что выключение Arf стимулирует онкогенез сильнее, чем активация ERas, а совместно эти изменения приводят к формированию крупных тератом.
С другой стороны, стабильная экспрессия трансгена Arf в мышиных ИПСК заметно защищала их от опухолевой трансформации, однако в сформировавшихся таки тератомах работа этого гена подавлялась.
Ну а самое интересное произошло, когда исследователи изучали реакцию фибробластов землекопа на выключение Arf в ходе производства ИПСК. У мышей такая манипуляция повышала эффективность перепрограммирования — подобно нокдауну последовательности Ink4a, кодирующей p16. А вот фибробласты землекопа не то что делиться и омолаживаться отказались, а приобрели все признаки сенесцентного статуса. Старение наблюдали и при отключении Arf у стрессированных фибробластов, в которых этот ген дерепрессировался в ответ на активацию онкогена c-Myc либо серийные клеточные пассажи. Дерепрессия Arf и Ink4a — нормальная реакция фибробластов многих млекопитающих на стрессы: перепрограммирование, активацию онкогенов, репликативный стресс. Стрессированные клетки стареют — и это их первая линия защиты от онкогенеза. У землекопа же, судя по всему, сформировалась дополнительная линия, срабатывающая в случае подавления синтеза Arf в стрессированных клетках (рис. 2). Этот феномен исследователи назвали старением, индуцированным супрессией Arf (ARF suppression-induced senescence, ASIS).
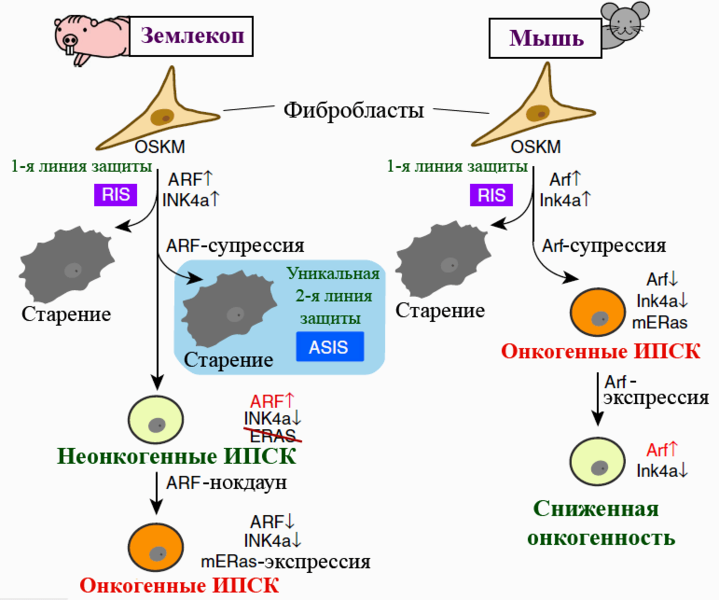 Рисунок 2. Перепрограммирование фибробластов голого землекопа и мыши. Особенности работы гена Arf и мутация гена ERas (обозначена перечеркиванием) «отключают» онкогенный потенциал ИПСК землекопа. Гены землекопа обозначены прописными буквами. OSKM — «генетический коктейль» для перепрограммирования (Oct4, Sox2, Klf4, c-Myc). Под старением подразумевается сенесценция клеток. mERas — мышиный, то есть полноценный, вариант гена. RIS — старение, индуцированное перепрограммированием. ASIS — старение, индуцированное супрессией Arf.
Рисунок 2. Перепрограммирование фибробластов голого землекопа и мыши. Особенности работы гена Arf и мутация гена ERas (обозначена перечеркиванием) «отключают» онкогенный потенциал ИПСК землекопа. Гены землекопа обозначены прописными буквами. OSKM — «генетический коктейль» для перепрограммирования (Oct4, Sox2, Klf4, c-Myc). Под старением подразумевается сенесценция клеток. mERas — мышиный, то есть полноценный, вариант гена. RIS — старение, индуцированное перепрограммированием. ASIS — старение, индуцированное супрессией Arf.
Японским биологам удалось слегка проникнуть в таинство работы этого уникального механизма. Они изучили в фибробластах землекопа деятельность ряда ингибиторов клеточного цикла, обычно регулирующих старение клеток. Ранее было показано, что старение мышиных фибробластов индуцировалось гипофосфорилированием белка Rb (только фосфорилированный Rb позволяет клетке готовиться к делению) и фосфорилированием АКТ. Гипофосфорилирование Rb — ключевого, как и p53, контролера клеточной пролиферации — обычно обусловлено работой таких ингибиторов цикла, как p27, p21 и p16. Однако в фибробластах землекопа при ASIS в гипофосфорилирование Rb эти ингибиторы не были вовлечены. Фосфорилирование же АКТ происходило совместно с активацией пролиферативного ERK-пути.
Таким образом, устойчивость ИПСК голого землекопа к онкогенезу, по мнению авторов работы, обусловлена специфической регуляцией гена Arf и повреждением гена ERas. Дальнейшее изучение феномена ASIS поможет до конца понять причины онкорезистентности этого зверька и, вероятно, поспособствует повышению безопасности человеческих ИПСК.
Источник: БИОМОЛЕКУЛА

