Рис. 1. Нескончаемая гонка вооружений между паразитами-бактериофагами и их жертвами-бактериями лежит в основе быстрой эволюции тех и других.
Система наследуемого приобретенного иммунитета CRISPR-Cas, широко распространенная у прокариот, надежно защищает своих обладателей от вирусов. Однако вирусы, постоянно мутируя, способны быстро (иногда менее, чем за сутки) преодолевать иммунитет любой отдельно взятой жертвы. Как выяснилось, эффективность системы CRISPR обеспечивается тем, что благодаря ее работе разные бактерии учатся распознавать вирус по разным участкам его генома. В результате способы защиты бактерий от данного вируса становятся настолько разнообразными, что никакие точечные мутации уже не помогают вирусам эффективно приспособиться к коллективной обороне жертв. Это, в свою очередь, способствует эволюции специальных вирусных генов, подавляющих работу системы CRISPR в целом, а бактерии отвечают на это эволюцией новых вариантов системы CRISPR — но такие изменения требуют большего времени.
Работа системы CRISPR-Cas основана на том, что небольшой фрагмент, вырезанный из проникшей в бактериальную клетку чужеродной (например, вирусной) ДНК, вставляется в специальный участок (локус CRISPR) генома бактерии. Каждый локус CRISPR содержит множество таких вставок («спейсеров»), представляющих собой кусочки наследственного материала паразитов (вирусов, плазмид, мобильных элементов). На основе спейсеров синтезируются молекулы РНК, комплементарные участку генома паразита. Эти РНК в комплексе с белками Cas используются затем для опознания и обезвреживания чужеродной ДНК с такой же последовательностью нуклеотидов. Таким образом, если в клетку однажды проникла вирусная ДНК, но клетка ухитрилась выжить и встроила кусочек вирусного генома в свою хромосому, то последующие попытки таких же вирусов заразить эту клетку или ее потомков будут пресекаться быстро и эффективно.
Впрочем, вирусы не склонны долго оставаться «такими же». За счет случайных мутаций и отбора они умеют обходить иммунную защиту жертв. Чтобы данный спейсер потерял свою эффективность, достаточно, чтобы комплементарный ему фрагмент вирусного генома хотя бы чуть-чуть изменился. Поэтому вирусы успешно и порой очень быстро преодолевают приобретенный иммунитет бактерий за счет точечных мутаций. С другой стороны, системы CRISPR очень широко распространены у прокариот и, по-видимому, обеспечивают своим обладателям надежную защиту. Что же позволяет этим системам на равных соревноваться с быстро эволюционирующими паразитами?
Генетики и микробиологи из Великобритании, Франции и США предположили, что важный вклад в эффективность CRISPR вносит то обстоятельство, что в ответ на одну и ту же вирусную инфекцию даже генетически идентичные бактериальные клетки вставляют в свой геном разные спейсеры, соответствующие разным участкам генома вируса. В результате популяция жертв быстро приобретает генетическое разнообразие, что сильно усложняет стоящую перед вирусами эволюционную задачу. Приобретя точечную мутацию, защищающую от одного спейсера, вирусы смогут заразить только небольшую часть популяции жертв. К счастью для бактерий, бактериофаг не может определить заранее, какие спейсеры имеются у данной клетки: это станет ясно, только когда он впрыснет в нее свою ДНК, а тогда уже будет поздно передумывать. Поэтому большинство фагов в полиморфной популяции жертв обречено на гибель, даже если у фагов то и дело появляются точечные мутации, защищающие от того или иного спейсера. Чтобы защититься сразу от многих разных спейсеров, фагу нужно одновременно приобрести целый комплекс необходимых точечных мутаций, что крайне маловероятно, ведь мутации случайны.
Проверка этих предположений проводилась на бактериях синегнойной палочки (Pseudomonas aeruginosa) и фагах DMS3vir. Для начала авторы убедились, что система CRISPR действительно надежно защищает бактерий от данной разновидности фагов. В популяциях «диких» бактерий внесенные исследователями фаги полностью вымерли всего за 5 дней. В культурах бактерий с отключенной системой CRISPR вирусы чувствовали себя вольготнее: за 30 дней, пока продолжался эксперимент, вирусы не вымерли ни в одной из линий. В первом случае все бактерии, как и следовало ожидать, выработали наследуемый приобретенный иммунитет на основе CRISPR. Бактерии с отключенной системой CRISPR тоже выработали кое-какую защиту, но на другой основе: у них распространились мутации, меняющие поверхностный белковый рецептор, за который цепляется фаг, чтобы заразить клетку. По-видимому, второй способ оказался менее эффективным и не позволил популяциям полностью избавиться от паразита, как это сделали популяции с работающей системой CRISPR.
Авторы подчеркивают, что полное вымирание вирусов в популяциях дикого типа является неожиданным результатом, поскольку известно, что вирусы в принципе умеют обходить CRISPR-иммунитет при помощи точечных мутаций. Может быть, все дело в разнообразии спейсеров, сформировавшихся у бактерий внутри каждой из подопытных популяций? То, что спейсеры действительно получаются разные, было показано в прежних экспериментах. Теперь нужно было доказать, что это разнообразие вносит вклад в эффективность коллективной иммунной защиты. Для этого необходимо сравнить устойчивость к вирусам у популяций с разным уровнем разнообразия спейсеров.
Чтобы получить такие популяции, авторы взяли свои подопытные линии, победившие вирусов при помощи CRISPR, и выделили из них 48 индивидуальных клонов (то есть взяли 48 индивидуальных клеток и получили от каждой многочисленное потомство). Ученые ожидали (и эти ожидания впоследствии подтвердились), что спейсеры у всех или почти всех клонов окажутся разными. Затем из этих клонов были составлены популяции пяти типов, различающиеся по уровню генетического разнообразия: популяции из одного клона (монокультуры) и смешанные популяции, составленные из 6, 12, 24 и 48 клонов.
Эти популяции затем подвергались заражению вирусами. На этот раз ученых интересовала в первую очередь эволюция вирусов, а именно их способность преодолевать иммунную защиту жертв. Поэтому наблюдения продолжались всего 3 дня — время, достаточное для заметных эволюционных изменений у вирусов, но недостаточное, чтобы подопытные популяции бактерий успели, создавая новые спейсеры, выровняться по уровню генетического разнообразия.
Результаты подтвердили ожидания авторов. За трое суток вирусы полностью вымерли во всех популяциях жертв, составленных из 24 и 48 клонов, и во многих популяциях, составленных из 12 клонов. В наименее разнообразных популяциях, составленных из одного или шести клонов, вирусы в большинстве случаев уцелели.
Каждые несколько часов в течение этого трехдневного эксперимента часть вирусов изымалась для детального анализа. Фагов подвергали полногеномному секвенированию, а также внедряли в чистые культуры каждого из 48 клонов бактерий, чтобы посмотреть, в каких случаях вирусы научились преодолевать иммунную защиту жертв.
Оказалось, что у тех вирусов, которые три дня эволюционировали в монокультурах бактерий, в большинстве случаев закрепились мутации, делающие соответствующий спейсер неэффективным. Причем происходило это, как правило, уже в первые сутки. Только с пятью из 48 монокультур вирусам не удалось справиться. Как выяснилось, в трех случаях из этих пяти у бактерий сформировалось не по одному, а по два или более противовирусных спейсеров.
У вирусов, которые эволюционировали в бактериальных популяциях, составленных из 6 и 12 клонов, устойчивость к тем или иным спейсерам сформировалась лишь в немногих случаях. Ну а те бедолаги, которым пришлось эволюционировать в наиболее разнообразных популяциях жертв, составленных из 24 и 48 клонов, не научились преодолевать защиту ни одного из исходных клонов (рис. 2).
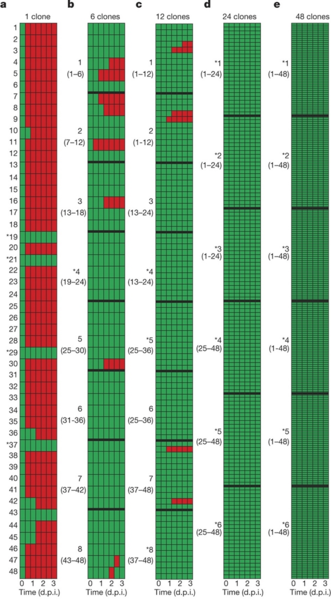
Рис. 2. Генетическое разнообразие жертв мешает вирусам преодолевать их иммунную защиту. Рисунок показывает результаты экспериментов по заражению вирусами, коэволюционировавшими с разными популяциями бактерий, каждого из 48 исходных бактериальных клонов. Каждая из пяти колонок соответствует серии экспериментов с одним из пяти уровней разнообразия жертв (слева направо: 1 клон, 6, 12, 24, 48 клонов). В каждом эксперименте вирусов для анализа брали спустя 0, 16, 24, 40, 48, 64 и 72 часа после заражения (6 вертикальных рядов внутри каждой колонки; внизу подписано время в сутках после заражения — d.p.i.). Каждую порцию полученных таким образом вирусов внедряли в чистую культуру каждого из 48 клонов бактерий и смотрели, смогут ли вирусы размножиться (красные квадратики) или вымрут (зеленые квадратики). Толстыми черными горизонтальными линиями разделены повторности, то есть разные подопытные популяции с данным уровнем разнообразия. Рисунок показывает, что в монокультурах бактерий вирусы в большинстве случаев меньше, чем за сутки, научились преодолевать иммунную защиту; в популяциях из 6 и 12 клонов это происходило редко, в популяциях из 24 и 48 клонов — никогда.
Причина, конечно, не в том, что у этих вирусов «правильные» мутации возникали с пониженной частотой. Мутагенез, скорее всего, протекал одинаково у всех вирусов. Просто в монокультуре единичная мутация, обеспечивающая защиту от данного спейсера, сразу дает вирусу огромное преимущество (поскольку позволяет заразить любую бактерию), а в полиморфной культуре из 48 клонов точно такая же мутация обеспечит вирусу-мутанту успех лишь с вероятностью 1/48. Даже если ему несказанно повезет, и он впрыснет свою ДНК именно в такую бактерию, от чьего спейсера он теперь защищен, его потомки снова столкнутся с той же проблемой. И она будет только усугубляться по мере снижения численности бактериального клона, ставшего уязвимым. Впрочем, до этого дело обычно даже не доходит: отбор практически не поддерживает у вирусов точечные мутации, защищающие от отдельных спейсеров, и вирусы вымирают, так и не успев преодолеть защиту ни одного из 48 клонов.
Эти выводы подтверждаются тем, что число мутаций, обнаруженных в геномах вирусов, эволюционировавших в монокультурах жертв, оказалось существенно выше, чем у вирусов, эволюционировавших в смешанных культурах: в первом случае отбор поддерживал у вирусов полезные мутации, а во втором нет. Кроме того, оказалось, что бактерии из смешанных культур за трое суток не приобрели новых противовирусных спейсеров, тогда как в монокультурах такие спейсеры появились. Это тоже логично: в смешанных культурах опасные для бактерий вирусы так и не появились, а в монокультурах возникли вирусы, пробивающие старую защиту, и система CRISPR создала дополнительные спейсеры.
Таким образом, разнообразие спейсеров, порождаемое системой CRISPR, действительно вносит важный вклад в ее эффективность. Если бы на каждую инфекцию система отвечала созданием одного и того же спейсера у всех бактерий, вирусы легко справились бы с таким иммунитетом. Но поскольку спейсеры каждый раз получаются разные, точечные мутации и отбор становятся для вирусов недостаточно эффективной эволюционной стратегией.
Это объясняет эффективность системы CRISPR и ее широкое распространение у прокариот. Осталось понять, почему бактериофаги до сих пор не вымерли, раз эта система так хороша. Ответ на этот вопрос отчасти уже известен: недавно у фагов были обнаружены особые гены, подавляющие систему CRISPR как таковую. В связи с этим возникает следующий вопрос: если существуют вирусные гены, полностью выводящие из строя CRISPR, то почему все вирусы ими не обзавелись? И что бактерии могут этим генам противопоставить? Впрочем, ответ на этот вопрос тоже уже отчасти известен: существует много разных вариантов системы CRISPR, каждый из которых уязвим только для некоторых вариантов генов анти-CRISPR и защищен от других. А содержать в своем геноме кучу дополнительных генов — дорогое удовольствие для вирусов, у которых отбор обычно поддерживает компактизацию генома (это повышает скорость размножения вируса).
По-видимому, антагонистическая коэволюция (гонка вооружений) между фагами и бактериями идет параллельно на разных уровнях и в разных временных масштабах. Формирование новых спейсеров и выработка вирусами точечных мутаций, делающих данный спейсер неэффективным, занимает всего несколько дней или даже часов. Выработка новых генов анти-CRISPR или новых вариантов системы CRISPR, неуязвимых для этих генов, возможно, требует тысяч и миллионов лет (хотя в мире вирусов и микробов все, что было кем-то когда-то изобретено, может потом быстро передаваться из рук в руки путем горизонтального переноса). Конца этой гонке не предвидится, и вряд ли кто-то выйдет из нее «окончательным победителем». Однако знание ее механизмов позволит людям в будущем хотя бы отчасти взять ее под свой контроль.
Источник: ЭЛЕМЕНТЫ БОЛЬШОЙ НАУКИ

