У наших клеток есть несколько способов защиты от вирусов. Один из них связан с белками APOBEC (apolipoprotein B mRNA editing enzyme, catalytic polypeptide-like). Ферменты APOBEC работают с мРНК, превращая азотистое основание цитозин в урацил. Такие модификации происходят обычно в ходе редактирования мРНК, и в результате с одного РНК-шаблона может синтезироваться несколько разных молекул белка.
Но этот механизм может быть задействован и при защите от чужеродного вторжения: так, APOBEC портят вирусные РНК, внося множественные мутации в вирусные белки и делая их нефункциональными.
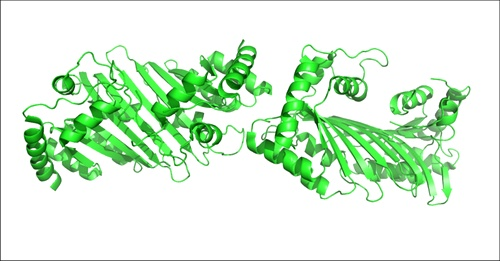
Структурная схема человеческого противовирусного белка APOBEC-2
Однако, как выяснили исследователи из Национальных институтов здравоохранения США и Института Броада, эти же противовирусные белки могут быть причиной массового появления онкогенных мутаций.
Об этом Дмитрий Горденин и его коллеги сообщали ещё в прошлом году в журнале Molecular Cell. В своей новой статье, появившейся в Nature Genetics, учёные анализируют то, как часто мутации, вызванные APOBEC, встречаются в разных видах рака.
Исследователи проверили около 1 млн мутаций в 2 680 образцах раковых тканей и обнаружили, что в некоторых из них число APOBEC-мутаций достигает 70%. Изменения, вызванные этим белком, особенно часто попадали в гены, связанные с контролем над опухолями, и чаще всего такие мутации можно было найти в опухолях мочевого пузыря, лёгких, молочных желёз, шейки матки и некоторых других. (Стоит также заметить, что в этом случае белок вносит ошибки не в РНК, а прямо в ДНК.)
Причиной подобной замены оснований может быть образование хлорцитозина по причине воспаления
«Химическое оружие», которое иммунитет использует для уничтожения инфекции и вредных молекул, заодно вызывает канцерогенные мутации в ДНК.
Часто приходится слышать о том, что хроническое воспаление повышает вероятность онкологических болезней – считается, что один из пяти случаев заболевания раком начинается с затянувшихся воспалительных реакций иммунитета.
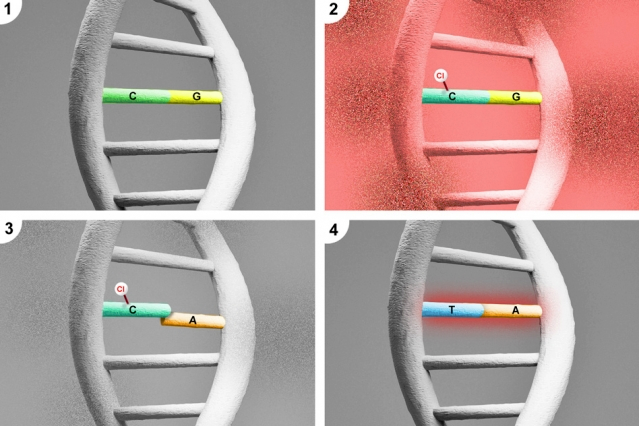
Мутационное замещение в ДНК цитозина (1) на тимин (4) через 5-хлороцитозин (2, 3).
После того, как врачи заметили статистическую взаимосвязь между тем и другим, начались активные поиски молекулярных механизмов. Как известно, воспалением иммунная система отвечает на появление в организме патогенов или же каких-то опасных веществ (или же веществ, которые она принимает за опасные). В ответную реакцию вовлечены клетки, которые должны поглощать инфекцию, и специальные агрессивные молекулы, которые разрушают и обезвреживают то, что раздражает иммунитет.
Среди таких «боевых отравляющих веществ» можно назвать пероксид водорода, оксид азота NO и хлорноватистую кислоту. Это довольно сильные окислители, и, кроме патогенов, патогенных молекул и больных тканей, они могут повреждать и здоровые клетки, находящиеся рядом с очагом воспаления.
Ранее исследователям из Массачусетского технологического института удалось заметить, что в тканях мыши, воспалившихся из-за бактерии Helicobacter hepaticus, возникают специфические повреждения в ДНК, связанные с тем, что азотистое основание цитозин превращается в 5-хлороцитозин. Модифицирующим агентом тут явно была вышеупомянутая хлорноватистая кислота. Обычно ненужные модификации генетических «букв» своевременно исправляются ДНК-репарирующими системами, однако 5-хлороцитозин накапливался и накапливался, что говорило о неспособности ремонтных систем исправить такую ошибку.
Вредные мутации часто возникают из-за того, что изменённые основания в ДНК претерпевают ряд превращений, и в результате оказываются заменены на другие, которых на их месте быть не должно. (Причём замена может происходить в рамках ремонта ДНК.)
Может ли превращение цитозина в хлороцитозин стать причиной злокачественного перерождения клетки? Чтобы узнать это, Джон Эссигман и его коллеги внесли в ДНК некоего бактериального вируса «хлорную» мутацию и пустили его размножаться в бактерию. Азотистые основания, наши «генетические буквы», расположены по принципу комплементарности, то есть если в одной цепи ДНК стоит цитозин (Ц), то в другой напротив него будет стоять гуанин (Г), а напротив аденина (А) – тимин (Т). Но, как пишут авторы работы в журнале PNAS, 5-хлороцитозин себе в напарники «требовал» не гуанин, а аденин. То есть после модификации в ДНК возникала структурная напряжённость из-за неспаренности нуклеотидов, которую спешили устранить специальные обслуживающие ДНК ферменты. В результате в соседней цепи «по просьбе» хлорцитозина появлялся аденин – и при следующем цикле удвоения молекулы напротив аденина появлялся уже не цитозин, который там стоял раньше до появления на нём хлорной метки, а тимин. Иными словами, происходила мутация с заменой нуклеотида – код-то исходно был другой. Зашифрованный здесь белок после синтеза будет нести в себе какую-то другую аминокислоту, как раз из-за того, что А заменили на Т.
Известно, что при появлении желудочно-кишечных опухолей в клетках активно происходят два типа мутаций: аденин замещается на гуанин, цитозин – на тимин. Именно вторую мутацию и удалось увидеть, наблюдая за судьбой хлороцитозина, причём частота её оказалась именно такой, какая наблюдается при онкологических процессах. Напомним, что хлорноватистая кислота, которая способна модифицировать цитозин, используется иммунной системой как химическое оружие, которое, как видим, вполне способно провоцировать канцерогенные мутации. Авторы работы полагают, что модификации могут случаться не только самой ДНК, но и в свободноплавающих нуклеотидах с цитозином, которые служат сырьём при синтезе ДНК.
Пока что эксперименты выполнялись в модельной системе, с вирусом и бактериями, и теперь их нужно повторить с человеческими тканями. Впрочем, то, что человеческие белки могут создавать такие же мутации, авторы работы уже проверили: если ремонтом ДНК занимался человеческий фермент, то он, как и его бактериальный «коллега», «шёл на поводу» у модифицированного цитозина и встраивал в комплементарную цепь аденин, то есть открывал путь к мутантному изменению кода.
Возможно, что такой же механизм провоцирует и другие виды рака, а не только желудочно-кишечные, но здесь опять-таки нужны дополнительные исследования. С другой стороны, это может быть не единственный способ, которым иммунитет способен провоцировать развитие опухоли: например, год назад в журнале Nature была опубликована статья, в которой говорилось, что воспалительные молекулярные сигналы, выделяемые нейтрофилами, побуждают рак кожи к метастазированию.
Исследования APOBEC особенно интенсивно проходили в контексте поиска способов борьбы с ВИЧ. Вирус иммунодефицита человека относится к семейству ретровирусов. Помимо иммунодефицитов, представители данного семейства способны вызывать целый ряд тяжелых онкологических, гемопоэтических (т.е. связанных с гемопоэзом - системой кроветворения) и неврологических заболеваний.
Вирусные частицы (вирионы) ВИЧ несут в своем составе геном, представленный молекулой РНК. После инфицирования такой частицей сначала в цитоплазме клетки происходит синтез вирусного ДНК-генома с использованием РНК в качестве матрицы. Все ретровирусы используют для репликации своего генома механизм обратной транскрипции: вирусный фермент обратная транскриптаза вначале синтезирует одну нить ДНК на матрице вирусной РНК, а затем уже на матрице синтезированной нити ДНК достраивает вторую, комплементарную ей нить. Образуется двунитевая молекула ДНК, которая, проникнув сквозь ядерную мембрану, интегрирует в хромосомную ДНК клетки и далее служит матрицей для синтеза молекул вирусных РНК. Эти РНК выходят из клеточного ядра и в цитоплазме клетки упаковываются в вирусные частицы, способные инфицировать новые клетки.
Геном вируса ВИЧ, помимо ферментов обратной транскрипции и структурных белков вириона, кодирует также несколько так называемых аксессорных (вспомогательных) протеинов, функции которых остаются не до конца выясненными. В прошедшем году внимание ученых, занимающихся ВИЧ, было приковано к одному из таких белков - vif (virus infectivity factor - фактор вирусной инфекционности). О возросшем интересе исследователей к этому белку указывает большое количество публикаций, посвященных его изучению и вышедших в 2003г. в таких престижных журналах, как Cell, Science и Nature. На ежегодной международной конференции по ретровирусам в Коулд Спринг Харборе в 2003г около четверти всех докладов имели отношение к vif и его функциям.
До недавнего времени было известно лишь, что этот белок значительно повышает инфекционность вируса в отношении некоторых типов клеток, таких, например, как Т-лимфоциты - основной мишени вируса в инфицированном организме.
Ранее предполагалось, что vif необходим вирусу для успешной сборки вирусных частиц и их почкования из клеток во внешнюю среду. Однако вирионы, продуцируемые зараженными клетками, в отсутствие vif физически ничем не отличались от нормальных, но в то же время были малоинфекционны. Ряд данных, полученных позднее, позволил предположить, что клетки, зараженные вариантом вируса, лишенным гена vif, способны проявлять некую антивирусную активность, и в них размножение ВИЧ поэтому замедляется. В случае же присутствия этого вирусного белка данная антивирусная активность подавляется. Это открытие побудило к активным поискам клеточного антивирусного фактора.
В 2002г. эти поиски увенчались успехом: группой ученых из Медицинского университета Пенсильвании был идентифицирован клеточный белок, ответственный за вирус-ингибирующую активность. Этот белок получил название APOBEC3G. Оказалось, что он принадлежит к семейству белков, участвующих в химических модификациях РНК и ДНК.
Ген данного белка был выделен и клонирован. Перенос его в клетки кишечной палочки сильно повысил уровень мутаций в бактериальной ДНК, причем эти мутации касались только замен основания G (гуанин) на А (аденин). Дальнейшие исследования выявили механизм таких замен.
Было показано, что у бактерий введенный искусственно белок APOBEC3G отвечает за удаление аминной группы (дезаминирование) из основания цитозин (С) ДНК, превращая его в урацил (U). Урацил является нормальным основанием в составе РНК, однако он несвойственен для ДНК. В результате действия APOBEC3G при репликации бактериальной ДНК появившийся в ней урацил вызывает ошибочное включение комплементарного ему основания А (вместо G, который комплементарен исходному С) в строящуюся вторую (дочернюю) нить ДНК. Таким образом у кишечной палочки происходит мутация - замена нуклеотидной пары C-G на U-A.
Бактериальные клетки лишены ядерной оболочки, поэтому у них трансгенный APOBEC3G имел свободный доступ к геномной ДНК. В клетках же высших (эукариотических) организмов APOBEC3G локализуется в цитоплазме, поэтому он не представляет большой угрозы для ДНК самой клетки, защищенной ядерной мембраной.
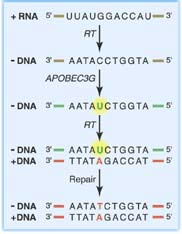
Рисунок. Дезаминирование первой нити вирусной ДНК.
После проникновения вирусной частицы, содержащей клеточный белок APOBEC3G, в новую клетку, вирусный фермент обратная транскриптаза (RT) обеспечивает синтез первой нити ДНК (-DNA) на матрице вирусной РНК (+RNA). Затем APOBEC3G индуцирует дезаминирование оснований цитозина (С), превращая их в урацил (U, выделен желтым). Во время синтеза второй цепи ДНК (+DNA) обратная транскриптаза включает основание А напротив U (тогда как в норме должен быть G напротив C). Интеграция такого вирусного генома в хромосому и воздействие на него клеточной системы репарации ДНК приводят к накоплению мутаций (обозначены буквами красного цвета) и формированию гипермутантного вирусного генома.
Но и вирусная ДНК также защищена от действия APOBEC3G: и на этапе заражения, и на стадии обратной транскрипции, и при встраивании в хромосому вирусный геном "обернут" вирусными белками. Можно ли "пробить" или "обойти" эту защиту? Оказывается, такой способ существует, и заключается не больше не меньше - в "инфицировании" самого вируса на стадии его упаковки.
Исследования показали, что белок APOBEC3G способен специфически проникать в новообразовавшиеся вирусные частицы ВИЧ. После инфекции такими вирионами клетки, когда, как уже говорилось выше, происходит синтез первой нити вирусной ДНК, APOBEC3G активирует в этой нити дезаминирование множества оснований цитозина (С). Цитозин превращается в урацил, и далее в процессе синтеза второй нити ДНК на матрице дезаминированной первой нити выполняется сценарий, описанный выше, т.е. происходит ошибочное включение А вместо G.
Дальнейшая судьба такой вирусной ДНК может быть различна. С одной стороны, ДНК ВИЧ, еще не интегрированная в хромосомную, может распознаваться клеточной защитной ферментной системой. В этом случае будет инициирована полная деградация (уничтожение) такой ДНК.
С другой стороны, если такая модифицированная ДНК интегрирует в клеточную хромосому, произошедшие в ней массовые замены С на U приведут к активации клеточной системы репарации повреждений, которая в итоге приведет к появлению так называемого гипермутантного вирусного генома. Количество мутаций (замен пар C-G на A-T) в таком геноме настолько высоко, что он неспособен кодировать ни одного нормального вирусного белка. Необходимо отметить, что такие гипермутантные вирусные геномы, в которых от 2 до 90% всех оснований G заменены на А, ранее уже выделялись из крови инфицированных ВИЧ, но до настоящего времени механизмы появления гипермутаций были непонятны.
Анализ ДНК vif-дефектных вариантов ВИЧ подтвердил наличие массовых гипермутаций, появляющихся после всего одного цикла репликации вируса в клетке, что явилось окончательным доказательством механизма антивирусной активности белка APOBEC3G. Была показана ингибирующая активность этого белка в отношении не только ВИЧ, но и целого ряда других опасных ретровирусов. Таким образом, APOBEC3G является естественным фактором, обеспечивающим специфическую защиту клетки от инфицирования ретровирусами. Этот белок, по-видимому, не имеет другой физиологической функции в клетке. Его активность в отношении других групп вирусов неизвестна.
Как же удается вирусу иммунодефицита защитить себя от клеточного "оружия массового мутирования"? Оказывается, оружием ВИЧ как раз и служит белок vif, с которого мы начали рассказ. Как было показано, уровень вирусной ДНК и время ее полужизни после инфекции клетки вариантом вируса иммунодефицита с дефектным вирусным белком vif значительно ниже по сравнению с нормальным вирусом. Каким же образом vif препятствует действию APOBEC3G?
В настоящее время известно, что vif существенно уменьшает количество проникающих в вирионы молекул APOBEC3G. Отчасти это происходит за счет vif-опосредованной деградации самого белка APOBEC3G и уменьшения его общего содержания в клетке. Vif способен связываться с APOBEC3G в цитоплазме инфицированных клеток и индуцировать последующее взаимодействие APOBEC3G с протеасомой - комплексом ферментов, ответственных за деградацию клеточных белков. Показано также, что vif каким-то образом способствует исключению APOBEC3G из собирающихся вирусных частиц (см. рис.). Не исключается и возможность прямого ингибирования белком vif ферментативной активности APOBEC3G в вирионах. В вопросе о механизмах действия vif еще много неясностей, требующих дальнейших исследований.
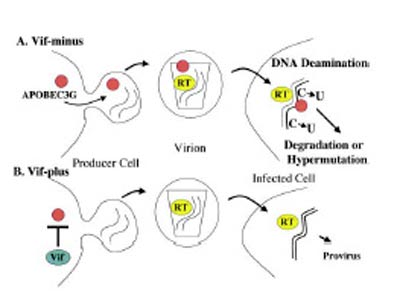
Рисунок. Эффект APOBEC3G на репликацию вируса иммунодефицита человека.
А. В процессе сборки вирусных частиц дефектного по белку vif (Vif-minus) варианта вируса клеточный белок APOBEC3G проникает в вирионы. При последующей инфекции новых клеток APOBEC3G вызывает накопление большого числа оснований урацила (U) в вирусной ДНК, что приводит к ее деградации или образованию гипермутантных вирусных геномов.
В. В случае присутствия вирусного белка vif (Vif-plus) клеточный белок APOBEC3G исключается из собирающихся вирионов, что ведет к образованию нормальных вирусных геномов.
Эффект APOBEC3G на репликацию вируса иммунодефицита человека.
А. В процессе сборки вирусн
В. В случае присутствия вирусного белка vif (Vif-plus) клеточный белок APOBEC3G исключается из собирающихся вирионов, что ведет к образованию нормальных вирусных геномов.
И так похоже, как минимум целых два механизма приводят к замене в геноме цитозина на тимин и соответственно гуанина на аденин. Наиболее сильный «перекос» в распределении мутаций в человеческом геноме состоит в том, что чаще всего мутируют нуклеотиды Ц (цитозины), за которыми следует нуклеотид Г (гуанин) CpG Островки
ДНК позвоночных ковалентно модифицируется метилированием цитозина (основания) в динуклеотидной последовательности 5'CpG3'.
CpG - это сокращение для цитозина и гуанина, разделенных фосфатом, связывающим эти два нуклеотида вместе в ДНК.
Островки CpG - это участки высокой плотности CpG, лишенные метилирования CpG, обнаруживаемого на промоторах большинства генов человека. Долговременный сайленсинг гена может быть обеспечен метилированием района островков CpG. Например, таким путем сайленсированы гены на неактивной Х-хромосоме и некоторые импринтированные гены. Кроме того, некоторые гены в раковых клетках аберрантно сайленсированы метилированием островков CpG.
Островки CpG были выявлены как фракция ДНК позвоночных, которая необычно часто расщепляется рестрикционными ферментами, чувствительными к метилированию ДНК. Клонирование этих так называемых "крохотных НраII-фрагементов" показало, что они происходят из последовательностей, обогащенных CpG и имеющих длину около 1 т.п.н., которые не метилированы в зародышевых клетках, у ранних эмбрионов и обычно также во всех соматических тканях. Островки CpG являются поэтому исключением из "глобального" метилирования CpG, преобладающего в большей части генома млекопитающих. Ранние работы по картированию промоторов индивидуальных генов выявили районы, обогащенные GC, вблизи промоторов генов, и сейчас очевидно, что большинство (если не все) островки CpG маркируют промоторы и 5'-домены генов. Приблизительно 60% генов человека имеют промоторы с островками CpG.
Для генома эукариот характерно наличие изохор. В GC богатых изохорах локализовано большое количество СрG-островков, характеризующихся очень высоким содержанием гуанина и цитозина (более 60%), представленных в виде кластеров неметилированных СрG-дуплетов и так называемых G/С-боксов - локусов, родственных сайту узнавания для одного из транскрипционных факторов Spl - (G)4С(G)4С. СрG-островки содержат много сайтов узнавания для чувствительной к метилированию эндонуклеазы HpaII , а также сайты для редкощепящих рестриктаз , узнающих неметилированные СрG-дуплеты. В частности, более 80% Nor 1-сайтов связано с СрG-богатыми островками.
Характерным свойством CpG-островков является их локализация вблизи структурных генов, преимущественно в их 5'-участках (регуляторные последовательности, промоторы, последовательности первого экзона). Анализ полностью расшифрованных к настоящему моменту нуклеотидных последовательностей хромосом 21 и 22 человека подтверждает это общее положение. Формальные признаки CpG-островков (присутствуют в промоторных зонах примерно 60% генов человека):
- размеры от 0,5 до 5 тыс. пар оснований (т.п.о.) (в среднем 1 т.п.о.);
- встречаемость примерно 1 на 100 т.п.о.;
- обычное (соответствующее расчетному 1:16) содержание динуклеотида CpG;
- С + G превышает 60%; отношение CpG/GpC не менее 0,6.
За несколькими известными исключениями (см. далее) CpG-островки неметилированы во всех типах тканей независимо от экспрессии соответствующего гена. С этой точки зрения важен вопрос о пространственной соотнесенности структурных генов и CpG-островков. Примерные расчеты свидетельствуют о том, что свыше половины генов, составляющих функционирующий геном человека, содержат CpG-островки: они имеются, по-видимому, у всех генов, выполняющих базовые клеточные функции (генов домашнего хозяйства), и у примерно 40% генов, выполняющих специализированные функции. Значительная часть тканеспецифических генов не имеет в своих промоторах CpG-островков: вместо них могут присутствовать одиночные CpG-динуклеотиды.
Наибольшая плотность СрG-островков наблюдается в теломерных участках хромосом 1 , 9 , 15 , 16 , 17 , 19 , 20 , 22. Точные молекулярные методы регистрации СрG-островков показали, что их число в геноме человека приближается к 45000.
В геноме млекопитающих CpG встречаются гораздо реже, чем можно было ожидать, исходя из вероятности их встречаемости, рассчитанной на основании G+C соседства в ДНК. При этом существуют протяженные последователльности с повышенным содержанием этого динуклеотида - CpG островки, участки ДНК длиной более 200 по с содержанием G+C более 50% и с содержанием CpG динуклеотидов более 60%. Они локализуются преимущественно в R-сегментах и поддерживаются в неметилированном состоянии в клетках зародышевой линии и нормальных соматических тканей. Исключение составляют островки в генах, подвергнутых импринтингу, в генах инактивированных X-хромосом, а также в повторяющихся элементах генома LINE и SINE (например, Alu), где они сильно метилированы. Длина промоторов, в которых встречаются островки, как уже говорилось выше, около 1 кб. Иногда эти островки могут находиться и в кодирующих частях генов. Вообще их позиция относительно старта транскрипции может сильно меняться от гена к гену.
Полагают, что именно неметилированное состояние CpG- островков стабилизирует их структуру в эволюции генома из-за более низкой скорости мутирования по сравнению с 5-mC, который в результате дезаминирования часто превращается в тимин со всеми вытекающими отсюда мутагенными последствиями. В гаплоидном геноме человека обнаруживают около 45000 CpG-островков, и считается, что большинство из них ассоциировано с генами. Промоторы многих генов домашнего хозяйства содержат неметилированные CpG-островки.
В настоящее время непонятен механизм поддержания CpG- островков в неметилированном состоянии. Поскольку Мтаза обладает способностью метилировать их in vitro, структурные особенности ДНК сами по себе не способны это обеспечивать. Считается, что в поддержании неметилированного состояния островков участвуют специфические белки хроматина. Хроматин CpG-островков не содержит гистона H1, а гистоны H2A и H2B в этих участках хроматина недоацетилированы. Кроме того, CpG-островки часто содержат сайты связывания фактора транскрипции Sp1, который, взаимодействуя как с метилированными, так и неметилированными сайтами, предотвращает их исходное или дальнейшее метилирование. Полагают, что именно этот фактор может играть ключевую роль в постоянном поддержании генов домашнего хозяйства в неметилированном активном состоянии.
Для соматических клеток, растущих в первичной культуре, характерно быстрое изменение характера метилирования ДНК. Это изменение часто связывают с ограниченным пролиферативным потенциалом культивируемых клеток и их старением как in vivo, так и in vitro. Многие гены культивируемых клеток гиперметилированы, а отдельные CpG-островки аутосом, поддерживаемые in vivo в неметилированном состоянии, переходят в метилированное состояние.
Полагают, что гиперметилирование ДНК и инактивация многих генов культивируемых клеток являются следствием отбора, направленного на выключение экспрессии генов, которые не требуются безусловно для выживания клеток в культуре. Кроме того, в культуре происходит отбор клеток на способность к быстрому делению, поскольку быстро делящиеся клетки вытесняют медленно пролиферирующие. Поэтому гены, вызывающие задержку клеточного цикла и терминальную дифференцировку клеток, например, p16 или MyoD1, быстро инактивируются у культивируемых клеток под действием мутаций или гиперметилированием.
У млекопитающих паттерны метилирования устанавливаются в ходе эмбрионального развития и поддерживаются механизмом копирования при делении клеток. Наследуемость паттернов метилирования ДНК делает эпигенетическую маркировку стабильной в ряду многих клеточных делений и, следовательно, составляет одну из форм клеточной памяти. Белок APOBEC3G участвует вместе с хлорноватистой кислотой в деградации по средствам гипермутирования метилированных ретровирусов и ретротранспозонов.
Источники статей обозначены активными ссылками в тексте.

