Ученые объединили методы иммунотерапии, цитотерапии и генотерапии для перепрограммирования Т-лимфоцитов в потенциальных «убийц» раковых клеток. Но и этого оказалось недостаточно — следующим шагом стало создание молекулярного «выключателя», с помощью которого можно регулировать время и силу действия активированных Т-клеток. Инновационный метод закладывает основу для резкого сокращения серьезных (а иногда и смертельных) побочных эффектов, вызванных терапией с использованием модифицированных Т-клеток.
Медицина перешла на новый уровень: клетки стали живым лекарством
В последнее время в терапии опухолевых заболеваний особое внимание уделяется адоптивной иммуноцитотерапии (от англ. adoptive — приемный). При этом часть клеток иммунной системы пациента искусственно «натравливают» на опухолевые клетки. Суть метода состоит в том, чтобы отобрать у пациента необходимые иммунные клетки, обработать их — например, иммунными цитокинами (небольшими белками, выполняющими функции регуляторов деления и дифференцировки специфических иммунных клеток), — а затем вернуть в организм уже активированные клетки, которые и будут помогать бороться с опухолями (рис. 1).
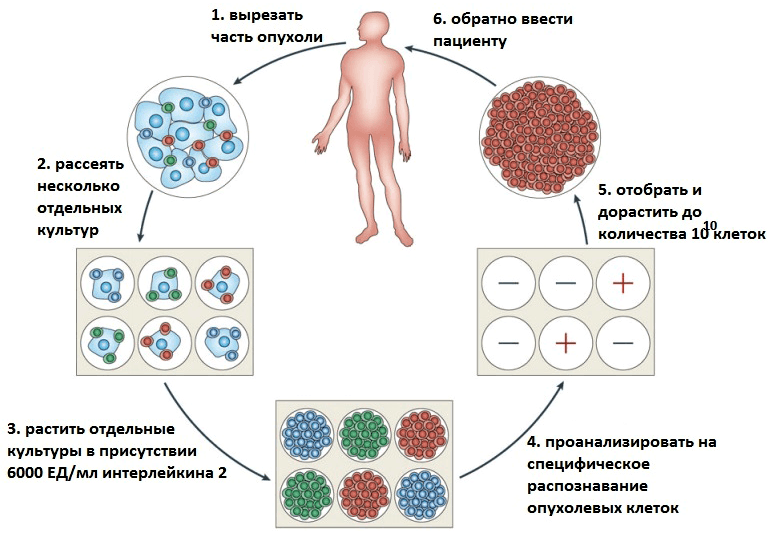
Рисунок 1. Схема получения антиопухолевых Т-клеток для адоптивной иммуноцитотерапии.
Впервые метод адоптивной иммуноцитотерапии был описан еще в 1988 году — у пациентов с метастатической меланомой (то есть раком кожи на четвертой стадии) наблюдалась регрессия заболевания при терапии с помощью их TIL-клеток (лимфоцитов, инфильтрующих опухоль). В настоящее время терапия метастатической меланомы на основе TIL-клеток является наиболее эффективным способом лечения данного заболевания, поскольку регрессия опухоли наблюдается у половины пациентов.
Существует несколько вариантов клеток, которые используются в адоптивной иммунотерапии; из них три используются при терапии опухолевых заболеваний: уже знакомые нам TIL-клетки (лимфоциты, инфильтрующие опухоль), LAC-клетки (лимфокин-активированные киллеры) и CIK-клетки (цитокин-индуцированные киллеры). На самом деле собственные Т-клетки организма тоже стараются бороться с опухолевыми клетками, только зачастую опухолевые клетки им «не по зубам». Не то, чтобы совсем — ведь существует иммунный надзор, осуществляемый Т-клетками и естественными киллерами (NK-клетками), с помощью которых иммунная система старается защититься от опухолей, — однако это вовсе не стопроцентная защита. Однако случается, что иммунный надзор не всегда достаточно силен, чтоб предотвратить развитие опухолей: так, при длительном применении иммунодепрессантов после трансплантаций органов повышается частота развития многих опухолей.
Необходима система наведения
Несмотря на сложность получения модифицированных клеток, а также сопутствующий риск возникновения серьезных побочных эффектов, все же главной проблемой метода иммуноцитотерапии является отсутствие способов прицельной доставки вводимых модифицированных иммунных клеток в опухоль. Раковые клетки часто делаются практически «невидимыми» для иммунной системы, и они образуют микросреду, которая подавляет активность и миграцию Т-клеток. Для того, чтобы сбросить мантию-невидимку с опухолевых клеток, Т-лимфоциты надо не только активировать, но и придать им способность прицельно узнавать опухолевые клетки. Т-клетки могут быть перепрограммированы методами генной инженерии путем введения генов, кодирующих рецепторы к опухолевым антигенам (TAA, tumour-associated аntigens) — оснащения собственной «системой наведения». Также можно заодно ввести гены для придания Т-клеткам устойчивости к иммуносупрессии для увеличения выживаемости или облегчения проникновения сконструированных Т-клеток в опухоль. В итоге, могут быть получены высокоактивные «наемные убийцы» раковых клеток.
Для получения эффективных «убийц» Т-лимфоциты модифицируют путем оснащения их искусственными химерными антигенными рецепторами (CAR, chimeric antigen receptors). Рецепторы химерные, поскольку одна часть (распознающая) была «позаимствована» у моноклональных антител, а часть, передающая сигнал, — у Т-клеточного рецептора (ТCR). В качестве внеклеточной «распознающей» части обычно служат вариабельные домены тяжелой и легкой цепи иммуноглобулинов необходимой специфичности (scFv), которые образуют специфичный к опухолевым клеткам антиген-связывающий участок (рис. 2).
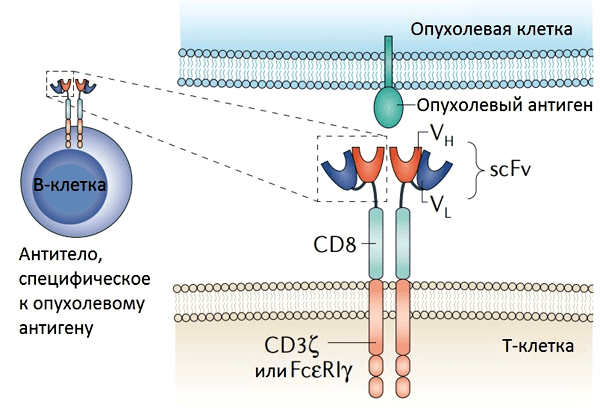
Рисунок 2. Структура химерного антигенного рецептора (CAR). CAR состоит из внеклеточного домена (одноцепочечного вариабельного фрагмента антитела (scFv)), соединенного с помощью цепей и трансмембранных доменов с цитоплазматической сигнальной областью. Гены, кодирующие scFv, получены из В-клеток, продуцирующих антитела, специфичные к опухолевому антигену. CAR существует в виде димера, и распознавание опухоли происходит напрямую (без участия MHC).
Все новое — это хорошо забытое старое. Первые Т-клетки с химерным антигенным рецептором были получены командой ученых под руководством профессора Эсхара (Zelig Eshhar); результаты работы были опубликованы еще в 1989 году. Эсхар понял, что, обладая данной техникой, Т-клетки можно запрограммировать на нацеленную атаку.
Однако с момента обнаружения химерных антигенных рецепторов до внедрения технологии в практику прошло больше 20 лет. За это время были улучшены химерные антигенные рецепторы — были созданы CAR 2-го поколения, в которые был внесен дополнительный сигнальный домен костимулирующей молекулы, который позволил улучшить активацию Т-клеток и их распространение. В CAR 3-го поколения был добавлен еще один сигнальный домен, что в конечном итоге повысило уровни выживания и размножения модифицированных Т-клеток [7] (рис. 3). В конечном итоге были улучшены способность к «выслеживанию» опухолевых клеток, а также уменьшены побочные эффекты.
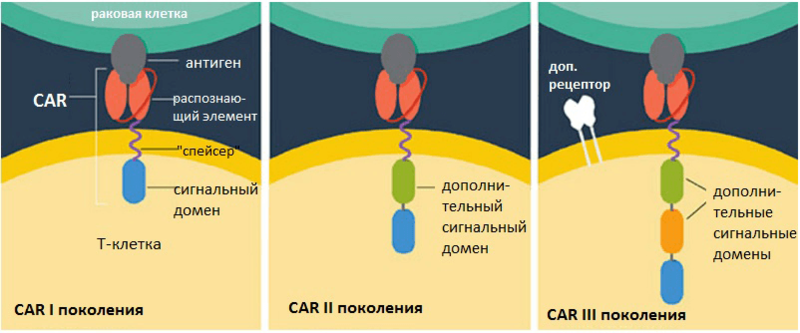
Рисунок 3. Эволюция химерных антигенных рецепторов.
Первые клинические испытания генетически модифицированных Т-лимфоцитов, несущих химерные антигенные рецепторы, прошли в 2012 году. Они выпали на долю девочки по имени Эмили, больной острой лимфобластной лейкемией. После того, как генетически модифицированные Т-клетки были обратно введены девочке, ее состояние резко ухудшилось, и она провела несколько недель в отделении интенсивной терапии на искусственной вентиляции легких. В какой-то момент жизнь Эмили висела на волоске, но в итоге девочка поправилась, и уже три года в ее организме врачи не находят даже единичных раковых клеток.

Рисунок 4. Бутылка с питательной средой для Т-клеток, которые после введения в них нового рецептора выращивают около 10 дней до достижения ими количества в несколько миллиардов. Тогда они могут быть введены в вены пациента.
Побочные эффекты новой терапии
Несмотря на то, что иммуноцитотерапия Т-клетками с CAR является прорывом в области лечения опухолевых заболеваний, есть еще ряд опасностей, которые могут поджидать за углом. Доктор Карл Джун из университета Пенсильвании был одним из первых, кто опубликовал успешные результаты лечения модифицированными Т-клетками, сравнил то, что происходит внутри тела пациента с «серийным убийством» и «массовым убийством». Когда миллиарды Т-клеток, которые были введены в организм, поделятся, то они смогут обнаружить и убить несколько фунтов опухоли. Но в этом тоже немало риска — многие пациенты страдают от синдрома высвобождения цитокинов (цитокинового шторма) — при борьбе Т-клетки с опухолевой клеткой высвобождается большое количество молекул цитокинов, что представляет угрозу для самого организма. Так, семь пациентов умерло вследствие этого синдрома.
Побочные эффекты связаны с мощной иммунной активностью модифицированных Т-клеток. Одним из камней преткновения является риск высокой токсичности, не позволяющий ввести подобное лечение на регулярной основе. «Т-клетки — действительно мощные создания», — говорит профессор Венделл Лим, заведующий отделом Департамента клеточной и молекулярной фармакологии Калифорнийского университета. — «Будучи активированными, они могут вызвать смерть. Нам необходима система удаленного контроля, которая сохранит силу этих модифицированных Т-клеток, и позволит специфично общаться с ними и управлять Т-клетками, находящимися в организме».
Т-клетки взяли под контроль
Ученые из Калифорнийского университета в Сан-Франциско создали молекулярный «включатель», с помощью которого можно управлять действиями генноинженерных Т-лимфоцитов. Как и обыкновенные Т-клетки, несущие CAR, новые Т-клетки с «включателем» будут взаимодействовать с опухолевыми клетками, но не будут переходить «в атаку», пока не будет введен специальный препарат. Данный препарат является своеобразным «химическим мостиком» внутри Т-клеток: он запускает иммунные реакции, «включает» их, переводя в активное состояние. Когда препарат перестает циркулировать в крови, Т-клетки снова переходят в «выключенное» состояние (рис. 5).
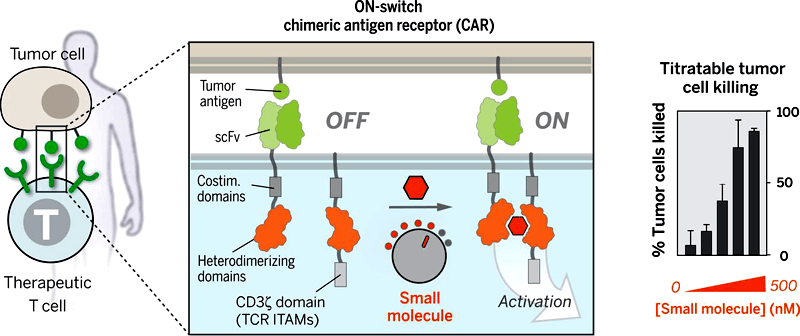
Рисунок 5. Титруемый контроль генноинженерных Т-клеток с помощью включаемого химерного антигенного рецептора. С обычным CAR Т-клетки активируются при соединении с клеткой-мишенью, при этом из-за очень сильного иммунного ответа есть риск высокой токсичности. «Включаемый» CAR требует небольшую стимулирующую молекулу для запуска терапевтической функции. Величину ответа (например, «убийства» клеток-мишеней) можно титровать, тем самым уменьшая токсичность при уменьшении количества небольшой стимулирующей молекулы.
Внедрение «пульта управления» в Т-клетку с химерным антигенным рецептором — это пример простой и эффективной стратегии совмещения собственных и автономных решений клетки (например, обнаружение сигналов болезни) с контролируемыми пользователем из вне. Перегруппировка и расщепление основных частей CAR обеспечивает возможность «включения» и «выключения» химерных антигенных рецепторов. Данная работа также подчеркивает важность разработки оптимизированных биоинертных «пультов управления», таких как небольшие молекулы и свет, вместе с их клеточными компонентами реагирования, в целях повышения точности контролируемой терапии.
Таким образом, правильно дозируя препарат, можно управлять уровнем иммунной активности модифицированных Т-клеток. В частности, благодаря данной технологии можно снизить отрицательные последствия синдрома высвобождения цитокинов. Также иногда нормальные клетки экспрессируют небольшие количества белков, которые являются мишенью для Т-клеток с CAR. Поскольку модифицированные Т-клетки вводят в кровяное русло, и они проходят через сердце и легкие, ткани этих органов могут быть повреждены прежде, чем Т-клетки достигнут своих намеченных целей в других частях тела. А с новой технологией Т-клетки будут в «выключенном» состоянии, пока не достигнут цели.
Иммунотерапия с помощью Т-клеток с CAR успешна против рака крови, но, когда дело доходит до твердых опухолей, которые образуются в толстой кишке, молочных железах, мозге и других тканях, модифицированные Т-клетки до сих пор не показывают высокой эффективности. Возможно, метод дистанционного управления Т-клетками позволит разработать более мощные версии химерных антигенных рецепторов, которые позволят Т-клеткам поражать твердые опухоли, при этом не обладая серьезными побочными эффектами.
Источник: БИОМОЛЕКУЛА

