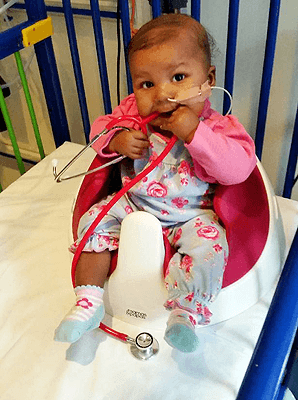
Лейла Ричардс — первый в мире ребенок, излечившийся от лимфобластного лейкоза с помощью геномного редактирования лимфоцитов. Болезнь диагностировали, когда девочке было три месяца. Химиотерапия и пересадка костного мозга оказались неэффективными, и врачи вынесли вердикт о неизлечимости такой агрессивной формы лейкоза, быстро перешедшей в терминальную стадию. Однако родители не согласились на паллиативную терапию, настояв на экспериментальном лечении. Запущенная в кровь гвардия генетически доработанных донорских лимфоцитов за три месяца справилась с предательски размножившимися лимфобластами, что медики расценили как «почти чудо».
В начале ноября 2015 года каждое уважающее себя издание написало об успешном излечении от лейкоза годовалой девочки Лейлы Ричардс. Острый лимфобластный лейкоз плохо поддается лечению у таких маленьких детей, и обычная химиотерапия помогает им лишь в 25% случаев. Когда стало ясно, что химиотерапия не справилась, родители девочки начали настаивать, чтобы врачи не ограничивались стандартными методиками, а попробовали все возможные способы для ее спасения. Доктора связались с учеными, разработавшими экспериментальную терапию лейкоза, основанную на генетической модификации иммунных клеток. Технология мало того, что применяла генную инженерию, к которой с таким опасением относится общественность, так еще и была опробована только на мышах. Членам комиссий по биоэтике и в страшном сне не может присниться одобрение такой методики для массового применения. Но случай Лейлы был исключением, потому что отработанными методами помочь ей уже точно не получалось. Девочке уже нечего было бы терять, и, если бы новый метод не помог ей резко пойти на поправку, мы бы никогда не услышали ее историю, как не слышим истории сотен тысяч других больных раком, которым не помогли никакие методы лечения.
И терапия сработала. Иммунные клетки донора модифицировали таким образом, чтобы они, во-первых, активно атаковали опухолевые клетки того типа рака, что диагностировали у Лейлы, а во-вторых, не причиняли вреда ее здоровым клеткам. Кроме того, модификации генома сделали донорские клетки устойчивыми к лекарствам, которые пациентка для страховки продолжала принимать, хотя они и не действовали на нее достаточно эффективно. Модифицированные иммуноциты донора помогли уничтожить опухолевые клетки и при этом не нанесли вреда здоровым тканям. Когда все признаки присутствия опухоли пропали, Лейле пересадили подходящий донорский костный мозг, который начал производить новые клетки иммунной системы, сходные с ее собственными. Вновь заработавшая иммунная система уничтожила генетически модифицированные клетки, выполнившие свою задачу.
Этот случай — не первый, когда генное редактирование применяли у людей. Подобные технологии уже использовали в прошлом году, чтобы повысить устойчивость к вирусу иммунодефицита у нескольких ВИЧ-инфицированных. Тот эксперимент тоже оказался удачным и улучшил показатели иммунитета пациентов. Тем не менее первый эпизод не вызвал такого общественного резонанса, как излечение Лейлы. Вероятно, здесь сыграла роль история маленькой больной девочки, которую терапия спасла от смерти буквально в последний момент. В первом же случае не было риска скорой смерти пациентов, которые к тому же были взрослыми.
Можно долго обсуждать, какие компоненты необходимы, чтобы привлечь к истории внимание публики, но в любом случае громкий успех генетической инженерии человеческих клеток очень важен для исследователей, разрабатывающих новые технологии. Благодаря этой счастливой истории, человечество еще на шаг приблизилось к медицине из фантастических романов. Самое интересное, что многие из технологий медицины будущего уже разработаны, но далеко не везде разрешены правительствами, одобрены комиссиями по этике или хотя бы вызывают доверие у простых граждан.
Компания Cellectis, создавшая клетки, которые вылечили острый лимфобластный лейкоз Лейлы, разрабатывает и другие полезные клеточные линии. Каждая из них нацелена на молекулы, характерные для определенного типа рака — к примеру, острого миелоидного лейкоза и миеломной болезни. Сегодня мало кто верит, что возможно создать лекарство от всех видов рака, но Cellectis планирует выпустить целый арсенал иммунных клеток, подходящих для лечения различных его типов. Клеточные линии Cellectis — это наиболее мягкий вариант генно-инженерной терапии человеческих патологий, поскольку такие клетки применяются только для того, чтобы разобраться с проблемой, а затем уничтожаются иммуноцитами пересаженного костного мозга. В этом смысле первый эксперимент по применению генной терапии к ВИЧ-инфицированным выглядит более радикальным: тогда изменяли собственные клетки крови пациентов, которые после модификации и возвращения в кровоток не планировалось оттуда удалять. На самом деле ученые даже рассчитывали, что модифицированные клетки в теле испытуемых размножатся, поскольку будут устойчивы к ВИЧ. Эти ожидания оправдались. Компания Sangamo, разработавшая терапию против ВИЧ, сообщает, что половина из дюжины участников первого эксперимента уже прекратили принимать противовирусные препараты, при этом их уровень Т-клеток, которые раньше атаковал вирус, остается высоким. Сейчас Sangamo дополнительно проверяет свою технологию еще на 70 пациентах.
В двух описанных экспериментах генетические модификации проводили вне организма пациентов: брали их собственные клетки или клетки доноров, изменяли ДНК и лишь потом вводили модифицированные клетки людям. Но таким способом можно победить далеко не все болезни. Во многих случаях дефектные клетки входят в состав органов, которые не получится безболезненно извлечь из тела пациента, а потом вернуть обратно. Чтобы лечить такие заболевания, потребуются действительно прогрессивные методы, с помощью которых можно будет изменять геном клеток прямо в составе организма. Для этого инструменты, модифицирующие гены (CRISPR, TALEN или системы, использующие белки с доменом «цинковые пальцы»*), необходимо разнести по множеству клеток организма (в идеале — по всем дефектным клеткам). И эта задача была бы крайне сложной, не будь природных систем проникновения в клетки и доставки туда ДНК — вирусов. Модифицированные вирусы, нацеленные на определенные типы клеток, уже довольно эффективны: в некоторых случаях им удается достичь 40% всех клеток-мишеней. Если целью выбирают «больные» клетки, то даже такая эффективность при очень многих заболеваниях позволяет улучшить состояние пациентов. Например, исследователям из Университета Дьюка удалось существенно улучшить состояние мышей с мышечной дистрофией — притом, что эффективность доставки системы, которая редактировала мутацию в генах мышечных клеток мышей, составила всего 20%. А компания Editas собирается использовать подобную технологию для редактирования генов клеток сетчатки, чтобы лечить глазные болезни.
* — Системы редактирования ZFN, TALEN и CRISPR/Cas9 выделяются тем, что основаны на сайт-специфическом действии разного типа нуклеаз in vivo. Кстати, донорские Т-клетки, спасшие Лейлу Ричардс, модифицировали с помощью нуклеазы TALEN, а ДНК Т-хелперов, ВИЧ-инфицированных обрабатывали ZFN (нуклеазой «цинковые пальцы»). Редактирование происходило ex vivo.
Помимо непосредственной атаки дефектных клеток, болезни можно лечить и другим способом. В качестве мишеней можно использовать здоровые клетки организма, заставив их производить необходимые для лечения белки. Чтобы полезного белка образовывалось много, нужно вставлять его ген в такое окружение, чтобы он активно работал. Sangamo предлагает использовать в качестве такого места ген альбумина — белка крови, который в больших количествах нарабатывается в печени. Исследователи уже пробовали вставлять в локус альбумина макак ген фактора свертывания крови IX, из-за недостатка которого развивается гемофилия B. В результате печень обезьян начала вырабатывать значительно больше этого фактора: его уровень в крови животных поднялся на 10%. Руководитель проекта Федор Урнов сравнил ген альбумина (вернее, очень уж активный промотор гена альбумина) с USB-портом генома, видимо, подразумевая, что в этот участок удобно «подключать» новые носители информации — гены, — поскольку там они точно будут работать активно. Вставляя «правильные» варианты генов в локус альбумина, исследователи из Sangamo собираются лечить и другие болезни — к примеру, нарушения синтеза гемоглобина. Рассматриваемый способ позволяет избавиться от многих рисков редактирования генома in vivo.
По сравнению с применением модифицированных клеток крови, которые при необходимости можно убрать из организма (что и произошло с модифицированными иммуноцитами после того, как они справились с лейкозом Лейлы), модифицировать клетки в составе органов намного рискованнее. Во-первых, крайне трудно гарантировать, что вирусные векторы, используемые для доставки систем модификации генов, не проникнут куда-то еще, кроме клеток-мишеней. В некоторых случаях модификация лишних клеток может быть опасной: к примеру, если целью являются клетки опухоли, которые нужно заставить прекратить деления, а модифицируются заодно и стволовые клетки, деления которых очень важны для здоровья организма. Другой важный момент — способность вирусных векторов долго оставаться в состоянии боевой готовности. В теории такие модифицирующие агенты могут сохранять активность годами, что не всегда полезно. Наконец, системы генетической модификации, не похожие на родные белки организма, могут вызывать иммунный ответ, что в сочетании с долгим сроком жизни агентов доставки ДНК может привести к хроническому воспалению и другим неприятным патологиям иммунитета.
В общем, биоинженерам еще есть над чем работать, но каждый удачный эксперимент, особенно на людях, повышает доверие общественности к их разработкам, и стимулирует ученых тянуть наш мир в будущее еще активнее.
Источник: БИОМОЛЕКУЛА

