Иммунотерапия опухолей — в некотором смысле парадоксальная область в современной биомедицине. Уже несколько десятков лет она является одним из самых модных и интенсивно развивающихся разделов экспериментальной онкологии, при этом в повседневной медицинской практике иммунотерапевтические подходы всё это время шли в глубоком арьергарде. Однако поразительные результаты клинических испытаний блокировки «тормозов» иммунного ответа положили начало новой эре в лечении рака, в которой иммунотерапии отведена, безусловно, одна из главных ролей.
Взаимодействие опухолевых и иммунных клеток — предмет пристального внимания иммунологов на протяжении уже не одного десятилетия. Это и неудивительно: слишком уж заманчива идея использовать для лечения онкологических заболеваний свой собственный, эволюционировавший миллионы лет механизм специфичного, направленного убийства дефектных клеток. В теории задача проста: нужно всего лишь дать иммунным клеткам «пощупать» молекулярную структуру опухоли, а после этого помочь проникнуть в гущу раковых клеток. Однако в реальности высокая генетическая изменчивость опухолевых клеток дает им возможность ловко избегать иммунного надзора, а также обезвреживать уже готовые к бою активированные иммунные клетки, передавая им разнообразные ингибирующие сигналы.
Лишь совсем недавно иммунологи нашли выход из сложившейся ситуации. Используя терапевтические препараты на основе антител, они научились блокировать ингибирующие сигналы, при помощи которых опухоль защищается от иммунных клеток, тем самым реактивируя защитную функцию последних и направляя их на борьбу с опухолью.
CTLA-4 и PD-1 — программа реабилитации ветеранов иммунного ответа
Как и любая армия, после завершения большой военной кампании система иммунного ответа нуждается в масштабной реорганизации, а солдаты — в социально-психологической реабилитации. То, к чему приводит игнорирование этого простого правила, можно было наблюдать в большинстве войн новейшего времени, когда непристроенные и отвыкшие от «гражданки» военные массово возвращались в мирную жизнь без должной реабилитации, после чего сходили с ума, подавались в криминал либо в радикальные военно-политические образования. Точно так же при отсутствии контроля над ходом иммунной реакции активированные клетки иммунной системы могут повредить окружающие органы и ткани, нарушить их функциональность и даже привести к смерти больного.
К счастью, наш организм намного умнее большинства мировых политиков и выработал немалое число высокоэффективных механизмов адаптации иммунных клеток к «мирной жизни» после завершения иммунной реакции.
Так, рецепторная молекула CTLA-4, находящаяся на поверхности активированных Т-клеток, является своеобразным тормозом («контрольной точкой», англ. checkpoint) для Т-лимфоцитов. «Тормозящий» сигнал через CTLA-4 запускается теми же самыми молекулярными партнерами (лигандами) — белками B7, — которые совсем недавно через рецептор CD28 запускали прямо противоположный процесс — активацию Т-лимфоцита к выполнению защитных функций (рис. 1). Прочность связывания с B7 у молекулы CTLA-4 намного выше, чем у CD28, и в какой-то момент ингибирующие сигналы начинают доминировать над активирующими. Деление Т-клеток и их функционирование постепенно останавливаются, иммунный ответ затухает, а воспаленная ткань постепенно возвращается к мирной жизни. Еще одним, не менее важным, «тормозом» является молекула PD-1, встречающаяся на поверхности многих иммунных клеток (Т- и В-лимфоцитов, клеток врожденного иммунитета) и обладающая, по-видимому, еще бόльшим спектром действия, нежели CTLA-4. Взаимодействуя со своими лигандами PD-L1 и PD-L2, она тоже эффективно ингибирует иммунный ответ.
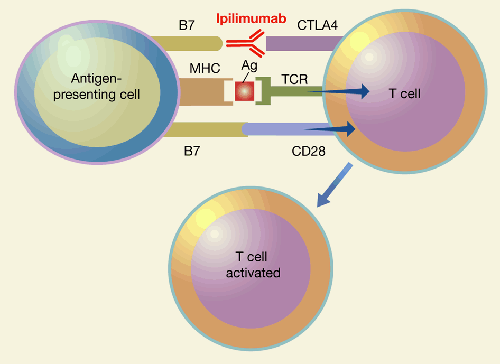
Рисунок 1. Схема работы ипилимумаба — препарата на основе моноклональных антител против CTLA-4. CTLA-4 конкурирует с CD28 за молекулы B7, не давая Т-клетке получить активирующий сигнал. При использовании ипилимумаба антитела блокируют CTLA-4, CD28 взаимодействует с B7, в результате чего Т-лимфоцит активируется и может убивать опухолевые клетки.
Обмануть обманщика: миссия выполнима?
Споры о том, существует ли постулированный Фрэнком Бернетом и Льюисом Томасом еще в середине прошлого века «противоопухолевый иммунный надзор», не утихают до сих пор. Очевидно одно: на той стадии, когда опухоль можно обнаружить с помощью методов современной диагностики, и тем более на стадии появления клинических симптомов, иммунная система не справляется с контролем опухолевого роста. «Молекулярное окружение», создаваемое умной и хитрой опухолью, делает невозможным эффективное уничтожение аномальных клеток иммунной системой. В частности, одной из стратегий ускользания рака от иммунного ответа является использование вышеописанных «тормозных» механизмов. Так, клетки многих злокачественных опухолей способны продуцировать молекулы PD-L1 и PD-L2, обманывая иммунные клетки и заставляя их «успокаиваться» вместо того, чтобы самоотверженно бороться с предателями.
Вся история лечения злокачественных опухолей указывает на то, что их крайне сложно обмануть. Чрезвычайно высокая генетическая изменчивость опухолевых клеток приводит к тому, что они могут приспособиться почти к любому терапевтическому воздействию, активируя обходные молекулярные механизмы выживания.
В то же время нормальные клетки иммунной системы куда более честны и прямолинейны. А что, если воздействовать не на опухолевые клетки, а на клетки иммунной системы — «открыть им глаза» на предателей, блокировав тормозные механизмы иммунного ответа?
Антитела — блокаторы
На помощь пришли старые добрые моноклональные антитела — высокоспецифичные молекулы, способные связываться с CTLA-4 или PD-1 и блокировать их функцию. Начиная с 90-х годов XX века многие научные коллективы, координируемые иммунологом Джеймсом Эллисоном, исследовали, действительно ли антитела, специфичные к рецептору CTLA-4, способны блокировать его и тем самым усиливать противоопухолевый иммунный ответ (рис. 1). Долгие годы работы наконец увенчались успехом: эффект таких антител был продемонстрирован на лабораторных животных, а позже и на пациентах, и в 2010 году препарат ипилимумаб (моноклональные антитела против молекулы CTLA-4) начал свое триумфальное шествие.
Результаты последних клинических испытаний поразительны: общая выживаемость пациентов, получавших только ипилимумаб, по сравнению со стандартными протоколами химиотерапии выросла почти на полгода. Здесь нужно отметить, что пациенты, принимавшие участие в этих исследованиях, страдали запущенными формами рака с множественными метастазами, и их опухоли не отвечали ни на какие схемы традиционной терапии. Для этой группы пациентов даже столь «скромное» продление жизни является поистине чудом. Поэтому неудивительно, что именно благодаря ипилимумабу в 2013 году область иммунотерапии опухолей была названа журналом Science прорывом года.
Новые перспективы и новые проблемы
Однако тормозные механизмы иммунной системы не ограничиваются CTLA-4. Несмотря на поразительные успехи блокады именно этой молекулы, значительная часть пациентов вообще не отвечала на такое лечение, поэтому следующим этапом развития данной стратегии стала блокировка других «контрольных точек».
Cразу же после разрешения применения ипилимумаба начались клинические испытания антител — блокаторов молекулы PD-1. Из-за отличных результатов предыдущих испытаний они шли по ускоренной программе, и уже в 2014 году новые препараты ниволумаб и пембролизумаб (и тот, и другой представляют собой моноклональные антитела против PD-1) были одобрены для лечения меланомы, а затем и ряда других опухолей.
В 2014 году стали известны результаты первых исследований эффективности препаратов, блокирующих молекулярного партнера PD-1 — PD-L1. Как и предполагалось, лекарство работает очень хорошо (рис. 2), так что следующие этапы его испытаний и выход на фармацевтический рынок не за горами.
Следует особо отметить, что блокаторы PD-1 и PDL-1 дают шанс на излечение даже тем пациентам, которые не ответили на выключение CTLA-4, а комбинация блокировки PD-1 и CTLA-4 повышает частоту длительных ремиссий почти в 3 раза (!) по сравнению с блокировкой только одного из тормозных путей.
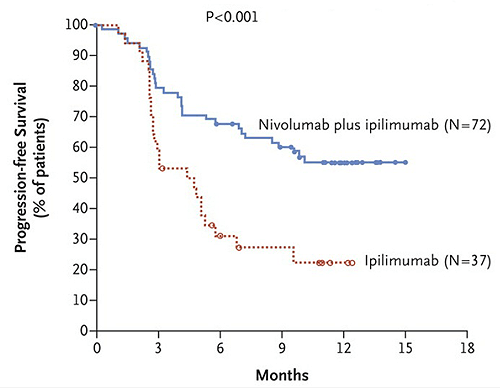
Рисунок 2. График выживаемости пациентов с меланомой при приеме ипилимумаба и ниволумаба. Комбинированное лечение (синяя линия) оказывается в три раза эффективнее, чем монотерапия ипилимумабом (красная линия).
С открытием блокаторов всё актуальнее становится вопрос поиска биомаркеров, предсказывающих, какие пациенты лучше всего будут реагировать на тот или иной препарат. Методы полногеномного секвенирования, визуализации опухолевых и иммунных клеток уже сейчас позволяют сузить круг пациентов, для которых этот вид иммунотерапии окажется наиболее эффективным. Однако разработка детального персонализированного подхода к выбору лечения еще впереди.
Несмотря на множество плюсов этой стратегии, она неизбежно несет и серьезные сложности в виде побочных эффектов. Дело в том, что влияние на регуляцию иммунологических процессов неизбежно ведет к их дестабилизации. Блокирование тормозных механизмов чревато повышенной агрессивностью иммунных клеток по отношению не только к опухоли, но и к нормальным клеткам организма, что чревато аутоиммунным поражением здоровых тканей. Даже при использовании одного препарата частота аутоиммунных поражений слизистых оболочек, кишечника и/или печени составляет более 50%. Поэтому крайне необходимо найти пути снижения нежелательных эффектов этих блокаторов. Так, ученые пытаются использовать в клинической практике комбинацию этих препаратов с лекарствами, обычно применяющимися для лечения аутоиммунных заболеваний. Такие лекарства взаимодействуют с молекулами, участвующими в развитии воспаления, блокируют их действие и тем самым снижают риск возникновения аутоиммунного процесса, не влияя при этом на эффективность основного препарата.
Возможно, наиболее важным результатом испытаний блокировки CTLA-4 и PD-1/PD-L1 стало то, что у значительного числа пациентов, получавших это лечение, метастатические опухоли исчезали полностью и не появлялись вновь на протяжении всего времени наблюдения. Эти данные не просто указывают на высокую эффективность такого вида терапии. В онкологии не принят термин «излечение», потому что опухоль может вернуться в любой момент спустя месяцы, годы и даже десятилетия после, казалось бы, полного уничтожения всей ее клеточной массы. Полученные же результаты вплотную приближают нас к еще недавно совершенно фантастической идее полного излечения от самых запущенных метастатических опухолей.
Источник: БИОМОЛЕКУЛА

