Вирусы похожи на идеальное оружие: смертоносные, незаметные, изменчивые, но в то же время просто устроенные. Найти изъяны их защиты не так-то легко. Их гораздо сложнее обезвредить, чем бактерии, против которых разработали множество лекарств. И всё-таки ахиллесова пята у вирусов есть. Более того, они сами выдают ее клеткам, обеспечивающим врожденный иммунитет для млекопитающих. Это вторичный посредник циклический гуанозинмонофосфат-аденозинмонофосфат (cGAMP), который «переезжает» вместе со своими незадачливыми хозяевами в каждую заново зараженную клетку.
Иммунитет человека, да и всех других млекопитающих, имеет свои средства для борьбы с вирусами, способные и заметить, и обезвредить опасные частицы. Существование вирусов так же зависит от синтеза белков, как и жизни клеточных организмов. Чтобы синтезировать белок, нужна РНК-матрица, а для ее появления, в свою очередь, требуется молекула ДНК. ДНК в зараженных клетках образуют даже те вирусы, у которых уже есть необходимая для трансляции информационная РНК (ретровирусы, самый известный из которых — ВИЧ). На ДНК-то вирус и попадается. Его гены находятся в цитоплазме клетки-жертвы. А вот ее «родные» гены надежно упакованы — часть в ядре, часть в митохондриях. В ответ на присутствие незваной двухцепочечной ДНК в цитоплазме активируется cGAS — синтаза 2´-3´-циклического ГМФ-АМФ. Получившиеся тандемные молекулы, называемые cGAMP (рис. 1), служат вторичными посредниками и передают сигнал о присутствии чужеродной ДНК стимулятору генов интерферонов — STING. Гены активируются, интерфероны образуются и перебрасываются на борьбу с вирусом.
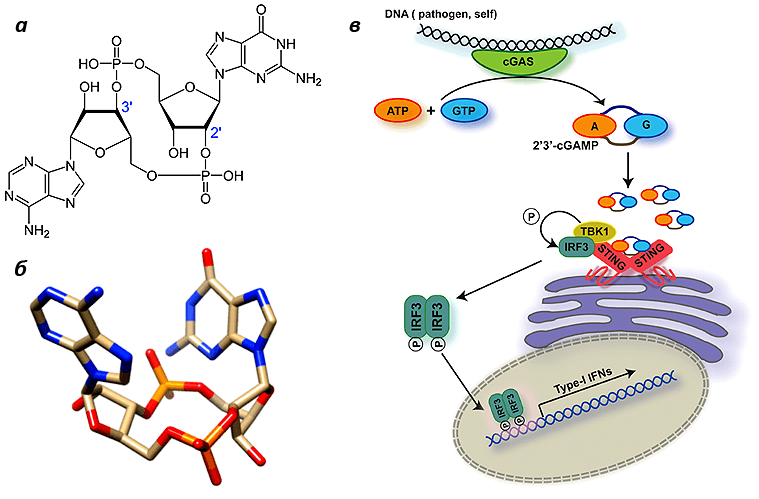
Рисунок 1. Молекула cGAMP и ее функция. а — Структурная формула; б — Пространственная структура; в — Молекулярный путь cGAS-cGAMP-STING. Служит для регистрации двухцепочечной ДНК в цитоплазме клеток млекопитающих. В норме ее там быть не должно.
Всегда ли клетки реагируют на вирус одинаково — независимо от того, есть ли у них инфицированные соседки? Теоретически это может быть правдой, но мы-то знаем, что в биологии словá «всегда», «никогда» и им подобные лучше не применять. Так же решили и авторы работы, опубликованной в Science. Они сконструировали гибридные вирусные частицы, у которых гены были от ВИЧ-1, а гликопротеины оболочки — от вируса везикулярного стоматита (VSV-G). В открытую рамку считывания вирусного гена env вставили ген зеленого флуоресцентного белка (GFP). Из-за этого новые вирусные частицы не могли собраться (ведь была нарушена структура гена белка оболочки), зато при каждой попытке сборки экспрессировали GFP, по интенсивности флуоресценции которого можно было определять количество и расположение вирусов.
Полученными вирусными частицами (HIV-1-GFP) заразили клетки линии 293T. cGAS в них нет, а значит, ни о каком иммунном ответе на ДНК вируса не могло быть и речи. Поэтому в часть клеток наряду с HIV-1-GFP ввели векторы, позволяющие синтезировать этот фермент. Только некоторым клеткам «подарили» ген cGAS дикого типа, в остальных случаях он был видоизменён так, чтобы его продукт не мог катализировать образование cGAMP. Затем из этих клеток выделили вирусные частицы и заразили ими клетки HEK293, синтезирующие STING и интерферон в ответ на присутствие cGAMP (во всех последующих экспериментах использовали клетки тех же линий в таком же порядке). Тут-то и настало время флуоресценции. В тех клетках, которым достались вирусы из 293T с внесенным геном cGAS дикого типа, флуоресценция была наиболее сильной (рис. 2). В клетках HEK293, которым достались вирусы из 293T с мутантной cGAS, флуоресценции и активации STING замечено не было.
Если судить лишь по этим данным, ничего нового мы пока не узнали. По ним видно только, что для выработки интерферона-β нужна работающая cGAS. Но это было известно и ранее: фермент запускает весь каскад реакций, куда же без него? Поэтому эксперименты продолжились. Теперь в клетки 293T вводили то поддельные вирусные частицы (конечно, вместе с геном cGAS), то клеточные везикулы, выделенные вместе с вирусами от предыдущих экспериментов, то отдельные вирусные белки, например, p24 и VSV-G. В первых двух случаях, несмотря на наличие cGAS и чужеродных элементов в цитоплазме, «зараженные» клетки не вырабатывали сколько-нибудь заметного количества интерферона-β. Зато компоненты вирусов давали явный иммунный ответ, не являясь ДНК, то есть прямой мишенью cGAS.
Теперь разгадка была близко, а именно где-то в вирионе. Это должна быть некая молекула, которая участвует в сигнальном пути cGAS-cGAMP-STING и при этом находится внутри вирусной частицы. Следующий после cGAS кандидат — cGAMP. Чтобы проверить наличие этого вещества в вирусах, исследователи, во-первых, пометили cGAMP в клетках 293T биотином, а во-вторых, методом масс-спектрометрии определили содержание этой молекулы в частицах HIV-1-GFP, выделенных из клеток 293T. И надо сказать, что она там обнаружилась. Кроме того, вирусные частицы из 293T, чей cGAMP был нейтрализован змеиной фосфодиэстеразой 1, не запускали выработку интерферонов в новых хозяевах.
Удивительно получается: вирусная частица каким-то образом захватывает с собой в каждую новую клетку своего «предателя» — молекулу, которая бьёт внутриклеточную тревогу! Кстати, и межклеточную тоже. Вирусы, которых в другом исследовании пересаживали в дендритные клетки, тоже содержали cGAMP и вызывали мощный ответ со стороны врожденного иммунитета. Этот ответ защищал от заражения еще не инфицированные клетки.
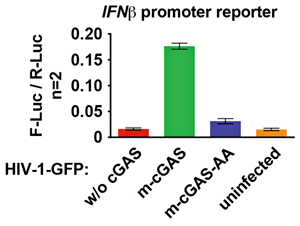
Рисунок 2. Результаты эксперимента по заражению частицами HIV-1-GFP клеток линии HEK293 с репортерной системой. Промотор гена интерферона-β (IFNβ) активируется в клетках HEK293, получивших вирусные частицы из клеток-продуцентов (293T) с внесенным геном мышиного фермента cGAS дикого типа (m-cGAS). Частицы из клеток с каталитически неактивным ферментом cGAS (m-cGAS-AA) и вообще без него (w/o cGAS) не индуцируют синтез репортерного белка (соответственно, за рамками репортерной системы — интерферона).
Почему сигналинг cGAMP так долго «оставался в тени»? Авторы работы предполагают, что дело в объекте изучения. Чаще всего образование вирусов исследуют на линии 293T, в клетках которой cGAS отсутствует. Это позволяет вирусам беспрепятственно размножаться, но исключает вероятность обнаружения переноса cGAMP от клетки к клетке.
Надо отметить, что интерес к сигналам, невольно передаваемым вирусами, отнюдь не только теоретический. Потенциально cGAMP таит в себе много применений. Например, он может стать реальным иммуномодулятором: большие количества этой молекулы активируют максимальное число дендритных клеток, а значит, иммунный ответ организма будет мощнее, чем обычно. К тому же, cGAMP реально ввести в состав какой-нибудь противовирусной вакцины наряду с антигенами нужного вируса и тем самым повысить активность дендритных клеток.
Источник: БИОМОЛЕКУЛА

