Ученые установили связь между стресс-индуцируемым гемопоэзом, возникновением повреждений ДНК в стволовых клетках крови, истощением их запаса и нарушениями в их функционировании. Оказывается, если в организме постоянно возникают инфекции или травмы, то постепенно в ДНК стволовых клеток крови накапливаются повреждения. Они приводят к истощению запасов стволовых клеток и, следовательно, к «старению» кроветворной системы. А в случае, если в системах репарации повреждений ДНК есть дефекты (как, например, при редком заболевании — анемии Фанкони), то истощение запаса стволовых клеток наступает гораздо быстрее.
Гемопоэтическая стволовая клетка.
Существует много разновидностей клеток крови (рис. 1). Каждый вид выполняет важные функции, но живут клетки крови сравнительно недолго: например, эритроциты живут около 120 дней, а лейкоциты — до нескольких месяцев. Для того чтобы постоянно пополнять запас выбывающих из строя бойцов, нужны кроветворные (их называют еще гемопоэтическими) стволовые клетки (ГСК). Популяция ГСК достаточно разнородна: клетки могут находиться на разных стадиях дифференцировки, то есть быть разной степени зрелости, могут обладать разным временем жизни, разной — краткосрочной и долгосрочной — регенеративной активностью, разными профилями экспрессии генов и разными эпигенетическими программами дальнейшей дифференцировки. В связи с этим среди стволовых кроветворных клеток особенно выделяют тип клеток с долгосрочной регенеративной активностью (ДР-ГСК), то есть способных воспроизводить популяцию клеток крови на протяжении всей жизни организма.
Разнообразие клеток крови
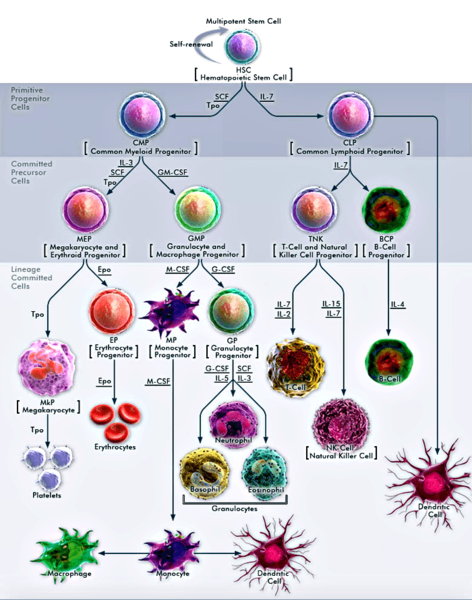
Рисунок 1. Разнообразие клеток крови и их происхождение от общего предшественника — гемопоэтической стволовой клетки. Из нее образуются более зрелые, но всё еще способные к дифференцировке миелоидные и лимфоидные предшественники. Миелоидные клетки, постепенно дифференцируясь, дают начало тромбоцитам, эритроцитам, моноцитам (а с ними — макрофагам и миелоидным дендритным клеткам), эозинофилам, нейтрофилам, базофилам. Лимфоидные клетки порождают естественных киллеров, Т-клетки, В-клетки и плазмоцитоидные дендритные клетки.
В норме ГСК, как ценное сокровище, спрятаны в костном мозге, внутри твердых костей. Они покоятся в особых нишах, в нежной соединительной ткани, богатой сосудами. Такая серьезная защищенность ГСК от воздействия внешних факторов неслучайна: спонтанное повреждение ДНК этих клеток может привести к онкологическим заболеваниям или попросту к истощению запаса клеток крови — постепенному старению кроветворной системы и даже острому дефициту клеток (цитопении).
Немецкие исследователи под руководством Майкла Мильсома и их коллеги из Швейцарии, Австралии и США выяснили, что повреждение ДНК гемопоэтических стволовых клеток крови случается во время активной стимуляции этих клеток к выходу из состояния покоя. Активация ДР-ГСК может стимулироваться спектром вырабатывающихся организмом веществ, которые напрямую не приводят к повреждению ДНК: интерферонами, гранулоцитарно-макрофагальным колониестимулирующим фактором, тромбопоэтином. Толчком к активации ДР-ГСК может стать и острая потеря крови. В своих экспериментах ученые имитировали заражение организма вирусной инфекцией, вводя мышам смесь полиинозиновых-полицитидиновых кислот для стимуляции выброса интерферонов: ведь известно, что интерфероны выделяются клетками организма именно в ответ на вторжение вируса. Затем ДР-ГСК извлекали, помещали в агарозный гель, лизировали и проводили электрофорез (такое исследование называется «метод ДНК-комет»). Отрицательно заряженная ДНК при приложении напряжения направляется к положительно заряженному электроду. Если ДНК повреждена, ее кусочки отрываются от ядра и под действием электрического тока образуют в геле так называемый «хвост кометы» (рис. 2). Именно так ученые обнаружили множество одно- и двунитевых разрывов ДНК в извлеченных стволовых клетках. О повреждениях ДНК свидетельствовало также появление в ДР-ГСК промежуточных белков и модификаций гистонов, необходимых для процесса репарации ДНК, то есть починки ее поломок.
Обнаружение двунитевых разрывов в активированных ДР-ГСК
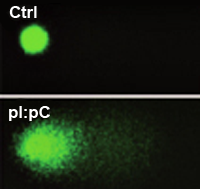
Рисунок 2. Обнаружение двунитевых разрывов в активированных ДР-ГСК. Вверху — неповрежденное ядро контрольной клетки, не прошедшей стресс-индуцируемую активацию. Внизу — ядро активированной клетки, окруженное «хвостом» из кусочков поврежденной ДНК.
Пожалуй, один из самых неприятных результатов разрывов ДНК — это последующая ковалентная сшивка двух ее цепей. РНК-полимераза во время транскрипции и ДНК-полимераза во время репликации не могут преодолеть такие структуры, а для их репарации необходима так называемая система репарации анемии Фанкони.
Анемия Фанкони — редкое наследственное заболевание, для которого характерно появление опухолей и злокачественной анемии. Известно, что анемия Фанкони возникает из-за дефектов в генах белков, отвечающих за репарацию ДНК. К ним относятся 15 белков группы FANC и еще два белка системы репарации RAD51C и XPF.
Большинство типов репарации ДНК не обходится без участия белков системы репарации Фанкони. Однако если часть репарационного пути вышла из строя, то починка повреждений осуществляется с помощью других систем репарации. И только ковалентные сшивки между цепями ДНК не поддаются починке в отсутствие белков системы репарации Фанкони.
И действительно, ученые заметили повышенный уровень экспрессии генов FANС и обнаружили скопления этих белков в клетках ДР-ГСК во время их стресс-индуцируемой активации. Кроме того, у мышей, которым была внесена делеция в ген белка FANCA (Fanca −/−) и, соответственно, нарушения структуры ДНК не могли быть ликвидированы, количество повреждений было существенно выше, чем в клетках животных с нормальной системой репарации.
На самом деле причина возникновения повреждений ДНК при стрессовой активации ДР-ГСК точно не известна. Зато известно, что одной из причин возникновения ковалентных сшивок двух соседних нуклеотидов в ДНК являются активные формы кислорода. Свободные радикалы, которые образуются в митохондриях, способны «сшивать» структурные единицы белков, жиров и ДНК. Существует даже теория, в рамках которой считается, что активные формы кислорода именно за счет внесения сшивок в молекулы провоцируют образование морщин и другие формы старения организма. Так или иначе, ученые обнаружили, что в активно пролиферирующих ДР-ГСК митохондриальный мембранный потенциал повышается по сравнению с клетками в состоянии покоя, а это может приводить к значительному увеличению количества активных форм кислорода.
При активации ДР-ГСК с поврежденной системой репарации не в живом организме, а в чашке Петри, ученые наблюдали быструю гибель уже второго поколения стволовых клеток. Также выяснилось, что если активация ДР-ГСК клеток происходит неоднократно, то почти у 80% мышей Fanca −/− наступает апластическая анемия, в то время как у мышей с нормальной системой репарации заболевание не возникает. Таким образом, без действующей системы репарации запасы ДР-ГСК костного мозга истощаются. Более того, ДР-ГСК здоровых мышей после стимуляции их делений имели сниженную способность к трансплантации и производили неполноценные миелоидные клетки в организме мышей-реципиентов.
Белки репарационного пути Фанкони
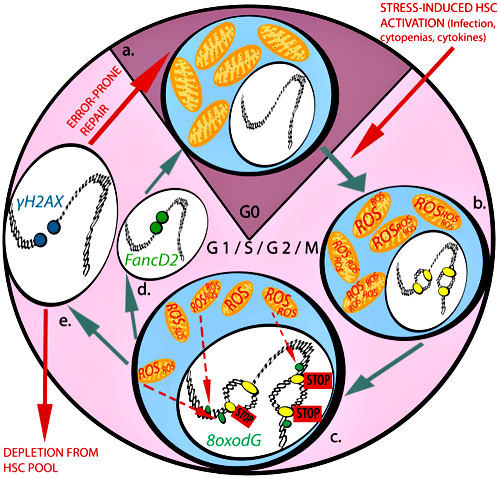
Рисунок 3. Белки репарационного пути Фанкони и их участие в репарации повреждений ДНК. Киназа ATR активирует белки репарации FANCI, FANCD2, FANCA и, возможно, FANCG. Ферменты USP1 и UAF1 удаляют убиквитин с белков FANCD2 и FANCI, подавляя репарацию. Деградация белка FANCM происходит после его фосфорилирования в период митоза с помощью киназы Plk1 и последующего убиквитинилирования. FANCE деградирует после фосфорилирования киназой Chk1.
В результате, ученые предложили следующую модель (рис. 3). Когда ДР-ГСК находятся в состоянии покоя и делятся редко, их энергетические запросы невелики. Поэтому митохондрии работают в обычном режиме, и образования активных форм кислорода не происходит. При инфекционных заболеваниях или потере крови пул клеток крови пополняется за счет активации ДР-ГСК. В этот момент в клетках усиливаются окислительные процессы, образуются свободные радикалы, которые могут приводить к повреждениям ДНК. Сама ДНК в этот период тоже находится в уязвимом состоянии из-за активных процессов репликации (удвоения ДНК, предшествующего делению клетки). Если репарация повреждений ДНК неэффективна, то клетки погибают. Или выживают, но несут мутации. В здоровом организме каждый раунд стресс-индуцируемой активации приводит к гибели/старению/накоплению мутаций в небольшом количестве ДР-ГСК. Однако на протяжении всей жизни подобная активация клеток случается многократно. Это может привести к тому, что запас ДР-ГСК истощится, и они больше не смогут эффективно производить новые клетки крови. А если системы репарации работают плохо (речь идет в основном о белках Фанкони), то пул ДР-ГСК истощается стремительно, что ведет к старению кроветворной системы и ее неспособности выполнять свои функции.
Источник: БИОМОЛЕКУЛА

