Две команды американских биологов создали несколько штаммов генетически модифицированных бактерий, способных расти только в присутствии синтетических аминокислот, не встречающихся в природе. Генетический код бактерий был изменен таким образом, что стоп-кодон UAG, в норме кодирующий окончание синтеза белковой молекулы, стал у них кодировать ту или иную нестандартную аминокислоту. Вставляя кодоны UAG в жизненно необходимые гены, удалось получить бактерий, не только неспособных жить в естественных местообитаниях, но и лишенных возможности выйти из-под контроля человека за счет мутаций или горизонтального переноса генов. Полученные результаты открывают путь к созданию синтетических организмов, генетически полностью изолированных от обычных живых существ и обладающих принципиально новыми свойствами, недостижимыми в рамках естественного эволюционного процесса.
Поразительное разнообразие жизни наводит на мысль о безграничных возможностях биологической эволюции. Это впечатление обманчиво: на самом деле возможности эволюции вовсе не безграничны — по крайней мере до тех пор, пока на помощь ей не придут ею же созданные разумные существа. Скорее всего, существует громадное количество жизнеспособных «проектов» живых существ, которые не могут быть реализованы просто потому, что к ним невозможно прийти естественным эволюционным путем, то есть за счет последовательного накопления небольших изменений или перекомбинирования имеющихся блоков с обязательным сохранением жизнеспособности на каждом промежуточном этапе.
Одним из ярких проявлений ограниченных возможностей эволюции является консерватизм (постоянство) генетического кода — системы соответствий между триплетами нуклеотидов (кодонами) и аминокислотами, из которых строятся закодированные в генах белки. Консервативен и стандартный набор из 20 аминокислот, из которых состоят почти все белки живых организмов. Правда, существует целый ряд небольших вариаций стандартного генетического кода, а изредка в состав белков включаются «неканонические» аминокислоты, такие как селеноцистеин и пирролизин. Но эти исключения — из разряда тех, что только подтверждают правило.
Изменить генетический код проще простого — для этого достаточно точечной мутации (замены нуклеотида) в антикодоне какой-нибудь тРНК. Включить в состав белков новую аминокислоту технически тоже нетрудно: для этого достаточно немного изменить структуру одной из аминоацил-тРНК-синтетаз. Проблема в том, что такая мутация повлияет сразу на множество свойств организма, ведь изменятся аминокислотные последовательности многих (возможно, даже всех) белков в клетке. Это почти наверняка приведет к снижению приспособленности, а значит, мутация будет отбракована отбором. Именно поэтому генетический код и набор аминокислот почти одинаковы у всех живых существ. Эволюция, по-видимому, не в силах радикально изменить эти параметры. Между тем преодоление этого ограничения могло бы пойти на пользу живым существам. Например, радикальное изменение генетического кода надежно защитило бы организм сразу от всех вирусов на свете, а включение в состав белков новых аминокислот позволило бы создавать белки с принципиально новыми, невиданными свойствами.
Впрочем, не стоит умалять творческие способности эволюции. То, чего она не смогла достичь прямым путем, она достигла окольным, создав разумного примата, поднявшего генно-инженерные технологии (впервые разработанные еще вирусами и бактериями) на невиданную доселе высоту.
В 2013 году биологи Фаррен Айзекс из Йельского университета, Джордж Черч из Гарвардского университета и их коллеги сообщили о создании бактерий с искусственно измененным генетическим кодом. Для этого из генома кишечной палочки Escherichia coli сначала были удалены все стоп-кодоны UAG (их заменили на другой стоп-кодон, UAA). Затем в бактерий ввели плазмиды, содержащие комплекс из двух генов. Первый ген кодирует модифицированную тРНК с антикодоном CUA, который комплементарно присоединяется к кодону UAG, второй — модифицированную аминоацил-тРНК-синтетазу (АРСазу), которая присоединяет к этой тРНК нестандартную аминокислоту. Технология изготовления таких тРНК и АРСаз была разработана ранее (Young et al., 2010. An enhanced system for unnatural amino acid mutagenesis in E. coli). В итоге получились бактерии, у которых кодон UAG кодирует нестандартную аминокислоту (рис. 1).
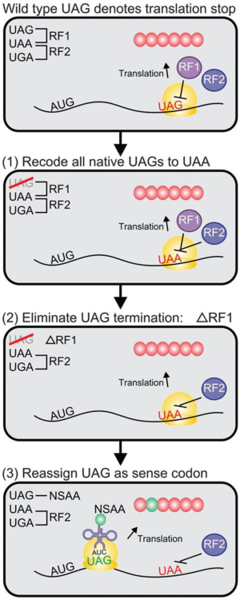
Рис. 1. Схема создания бактерий с измененным генетическим кодом. У обычной кишечной палочки, как и у большинства других организмов, кодон UAG кодирует окончание синтеза белка, то есть является стоп-кодоном. Кроме UAG, есть еще два стоп-кодона: UAA и UGA. Белок RF1 (release factor 1) помогает завершить трансляцию на кодоне UAG. Для того чтобы изменить генетический код, сначала все 321 стоп-кодонов UAG в геноме кишечной палочки были заменены на UAA, а ген, кодирующий RF1, был удален. Затем в бактерий ввели гены, кодирующие, во-первых, нестандартную тРНК с антикодоном CUA (такая тРНК комплементарно присоединяется к кодону UAG), во-вторых — модифицированный фермент аминоацил-тРНК-синтетазу, который присоединяет к этой тРНК синтетическую аминокислоту (NSAA, non-standard amino acid). В итоге получились «перекодированные» бактерии, у которых кодон UAG кодирует не окончание синтеза белка, а новую аминокислоту.
21 января 2015 года на сайте журнала Nature появились статьи двух исследовательских коллективов, один из которых возглавляет Айзекс, а другой — Черч. Обе команды, взяв за основу созданный ранее «перекодированный» штамм, сделали следующий логичный шаг: они изготовили микробов, у которых синтетические аминокислоты входят в состав жизненно необходимых белков. Такие микробы способны жить только в присутствии искусственных аминокислот, не встречающихся в природе. Это не позволяет им выйти из-под контроля человека и размножиться в естественных местообитаниях. Тем самым повышается уровень безопасности генетически модифицированных организмов (ГМО), которые в последние годы находят всё более широкое применение в сельском хозяйстве, медицине, биоэнергетике и других областях.
Методы и подходы, использованные двумя авторскими коллективами, сходны, хотя и различаются в технических деталях. Команда Черча работала с синтетической аминокислотой L-4,4’-бифенилаланином (bipA), а группа Айзекса — с p-ацетил-L-фенилаланином (pAcF), p-иодо-L-фенилаланином (pIF) и p-азидо-L-фенилаланином (pAzF). Первая команда вставляла кодоны UAG, кодирующие нестандартную аминокислоту bipA, в шесть жизненно необходимых генов, причем в эти гены дополнительно вносились «компенсирующие» мутации, благодаря которым пространственная структура белка не нарушалась из-за появления в нем bipA (но нарушалась при замене bipA на стандартную аминокислоту). Вторая команда работала с более широким кругом генов без внесения компенсирующих мутаций (нашлись гены, в которых внедрение нестандартной аминокислоты и так не нарушало работу белка).
В итоге удалось получить несколько штаммов, способных расти только в присутствии синтетической аминокислоты. Без нее синтез белка, в ген которого был вставлен кодон UAG, застопоривается на этом кодоне, в клетке не оказывается, нужного количества жизненно важного белка и бактерия погибает.
Зависимость генно-модифицированных бактерий от искусственных веществ позволяет контролировать размножение ГМО эффективнее, чем прежние методы. Например, если просто лишить бактерию способности к синтезу какого-то сложного вещества, необходимого для жизни, то она может получить недостающее вещество из лизированных (разрушенных) клеток других, немодифицированных бактерий, присутствующих в экосистеме. Такие ГМО успешно выживают в среде, содержащей лизированные клетки E. coli. Новым микробам, зависимым от искусственных аминокислот, этот не помогает, ведь необходимых им веществ нет ни в одном нормальном живом организме.
Однако выведение таких бактерий — синтетических ауксотрофов, зависимых от искусственных питательных веществ, — лишь первый шаг к заявленной цели. Ведь бактерии умеют мутировать и меняться генами друг с другом. Это дает им шанс избавиться от навязанной зависимости от синтетической аминокислоты.
Первые штаммы синтетических ауксотрофов, созданные авторами, имели лишь по одному кодону UAG, вставленному в тот или иной важный ген. Такие бактерии действительно иногда производят мутантов — «беглецов», у которых зависимость от нестандартной аминокислоты исчезает и они снова становятся способны расти в обычной питательной среде. К появлению беглецов приводит и совместное проживание с обычными кишечными палочками, умеющими передавать другим клеткам свою ДНК посредством конъюгации.
Отсеквенировав геномы беглецов, авторы выявили способы «бегства», а затем разработали методы борьбы с ними. Подопытные микробы избавлялись от зависимости по-разному. У одних фиксировались точечные мутации в кодоне UAG, что вело к замене нестандартной аминокислоты на стандартную. Это было типично для штаммов, полученных группой Айзекса; бактерии команды Черча были частично защищены от такого поворота событий компенсирующими мутациями, о которых говорилось выше. У других мутировал ген какой-нибудь тРНК, которая в результате приобретала антикодон CUA и начинала «считывать» кодон UAG, вставляя в полипептидную цепь обычную аминокислоту вместо синтетической. Кто-то выживал за счет мутационной поломки системы уничтожения «бракованных» (неправильно свернутых) белков, так что дефектные белки, синтезируемые на матрице гена с кодоном UAG в отсутствие необходимой синтетической аминокислоты, не уничтожались и кое-как справлялись со своей функцией.
Эксперименты, проведенные обоими коллективами, показали, что самым верным и универсальным способом снизить частоту побегов до исчезающе малых величин является простое увеличение числа жизненно важных генов, в которые вставлен кодон UAG. Если, к примеру, у бактерий с одним таким геном один «беглец» приходится на десять миллионов клеток (приблизительно такие цифры были получены в экспериментах), то добавление второго гена с кодоном UAG может понизить частоту побегов до одного случая на десятки миллиардов. Обеим командам удалось получить штаммы с двумя или тремя UAG-содержащими генами, у которых частота побегов была настолько низкой, что находилась за порогом чувствительности применявшихся методов. Конечно, если в триллионной популяции бактерий за 20 дней не появилось ни одного беглеца, это еще не значит, что они не появятся и в сикстиллионной популяции за 20 лет. Но ведь речь пока идет только о двух или трех UAG-содержащих генах! Если довести их число, скажем, до сотни, то вероятность побега будет практически полностью исключена.
Есть и другие способы уменьшить эту вероятность. Например, UAG-содержащие гены должны быть разбросаны по геному, а не сконцентрированы в одном участке хромосомы. Тем самым предотвращается возможность замены модифицированного участка в ходе горизонтального переноса генов. Это было проверено в экспериментах по совместному культивированию «перекодированных» микробов с обычными E. coli, способными передавать другим бактериям свою ДНК. Если UAG-содержащие гены модифицированного микроба разбросаны по всему геному, то для того, чтобы заменить их все на «исходные версии», ему придется позаимствовать очень много чужой ДНК, что связано с большим риском. Ведь его ожидают неприятности, если он приобретет версию важного гена, в которой UAG используется обычным образом, то есть в качестве стоп-кодона (а при массированном заимствовании чужих генов это обязательно рано или поздно произойдет). Не поздоровится ему и в том случае, если он избавится от модифицированного комплекса тРНК/ААРс раньше, чем все UAG-содержащие гены будут заменены на «исходные».
Еще одна хорошая идея — вставлять кодоны UAG, кодирующие синтетическую аминокислоту, в функционально важные участки генов, кодирующие активный центр фермента или те части белковой молекулы, которые необходимы для взаимодействия с другими белками. Чтобы белок при этом сохранил функциональность, в него необходимо вносить компенсирующие мутации, то есть заменять некоторые другие аминокислоты, которые будут взаимодействовать с синтетической. Чем больше таких компенсирующих мутаций, тем меньше шансов, что обратная замена синтетической аминокислоты на стандартную окажется совместима с жизнью.
Не за горами тот день, когда развивающиеся технологии позволят перекодировать не один, а сразу несколько кодонов стандартного генетического кода. Тогда можно будет сделать ГМО, зависящие не от одной, а от целого набора не встречающихся в природе аминокислот. Такие искусственные организмы будут полностью генетически изолированы от обычных живых существ. Любой генетический обмен между ними станет невозможен. Их не тронет ни один существующий вирус, но и они нас никогда ничем не заразят. И они смогут жить и размножаться лишь там, где мы им позволим.
Едва ли это научное достижение успокоит страстных борцов с ГМО, ведь эти страсти (там, где они есть) подпитываются вовсе не рациональным взвешиванием предполагаемых рисков. Главное значение открытия, конечно, не в этом. Полученный результат — важный шаг к преодолению природных барьеров, ограничивающих творческие силы эволюции, и к созданию безопасных синтетических организмов чуть ли не с любыми желаемыми свойствами.
Источник: ЭЛЕМЕНТЫ БОЛЬШОЙ НАУКИ