Профессор молекулярной и клеточной биологии Института биологических исследований Солка Ян Карлзейдер в лаборатории.
При всем типовом разнообразии раковые опухоли имеют общую черту – беспредельное деление клеток. В значительной степени этот нерегулируемый рост обусловлен тем, что опухолевые клетки могут восстанавливать защитные концы своих хромосом, состоящие из повторяющихся последовательностей ДНК и белков. Как правило, деление клеток останавливается, как только эти структуры, называемые теломерами, «изнашиваются» и становятся слишком короткими. Но раковые клетки продолжают делиться, используя одну из двух стратегий их восстановления.
Одна из стратегий, реализуемая в 90 процентах видов рака, основана на усилении синтеза фермента теломеразы, удлиняющего теломеры. Менее изучена стратегия, используемая оставшимися 10-15 процентами видов рака, называемая альтернативным удлинением теломер (Alternative Lengthening of Telomeres, ALT). До сих пор объяснение биологами феномена альтернативного удлинения теломер, по существу, сводилось к тезису: раковые клетки могут восстанавливать длинные, хотя и «неряшливого» вида, теломеры без теломеразы. Однако, как именно это делается, оставалось неясным.
Профессор молекулярной и клеточной биологии Института биологических исследований Солка Ян Карлзейдер, и сотрудники его лаборатории сообщают о первой экспериментальной индукции ALT-программы восстановления теломер в клетках человека. Это открытие, опубликованное в журнале Nature Structural and Molecular Biology, представляет факторы, являющиеся драйверами ALT-зависимого роста раковых клеток как потенциальные фармакологические мишени.
Профессор Карлзейдер занимается изучением того, как биохимия теломер влияет на развитие рака и процесс старения.
«Таргетинг теломеразы давно считается потенциальным методом лечения рака», - поясняет ученый, отмечая, что антителомеразные препараты против нескольких видов рака уже проходят клинические испытания (фазу II). «Но исследования на мышах показывают, что при подавлении теломеразы клетки могут активировать программу альтернативного удлинения теломер. Это делает абсолютно необходимой разработку способов блокирования ALT».
Чтобы узнать, как именно клетки включают программу альтернативного удлинения теломер, исследователи экспериментально удалили два белки, ASF1a и ASF1b, в нормальных клетках легких и в клетках раковой линии, бессмертие которых обусловлено теломеразой. Шапероны ASF1 – молекулярные «сопровождающие» гистоновых белков, комплекс которых с ДНК является структурным блоком хромосомы – нуклеосомой.
В ASF1-дефицитных клетках, как, собственно, и ожидалось, – учитывая потерю гистонового шаперона, – ученые наблюдали относительный дефицит нуклеосом в области теломер. При этом лишенные ASF1 раковые клетки продолжали беспрепятственно пролиферировать, хотя синтез теломеразы в них выключался, что могло означать только одно: опухолевые клетки умеют использовать вторую стратегию удлинения теломер.
Но самое интересное показала микроскопия: ядра лишенных ASF1 клеток содержали агрегаты теломерной ДНК, известные как PML-тельца. PML-тельца, названные так потому, что впервые были обнаружены в опухолевых клетках при промиелоцитной лейкемии (promyelocytic leukemia), являются характерным признаком ALT-зависимых типов рака.
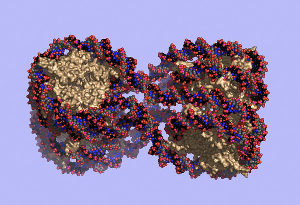
Модель нуклеосомы – элементарной единицы упаковки ДНК в клетке: нить ДНК обёрнута вокруг комплекса гистоновых белков.
«Масштабное образование PML-телец в нормальных клетках было неожиданностью», - комментирует первый автор статьи Родди О'Салливан, постдокторант лаборатории профессора Карлзейдера. «Это было первой подсказкой о том, что программа альтернативного удлинения теломер индуцируется потерей белков ASF1».
Чтобы подтвердить, что клетки включают ALT, ученые использовали все возможные средства. В качестве решающего аргумента постдокторант лаборатории Карлзейдера, соавтор исследования, Носика Арну прибегла к флуоресцентной микроскопии. В теломерный участок одной из хромосом ее коллеги встроили тэг, а она отследила, где этот тэг оказывался с течением времени, применив метод FISH, позволяющий визуализировать целую хромосому. Она установила, что потеря ASF1 инициировала своего рода внутриядерный «пинг-понг»: клетки размножили тэг и перебрасывали его из хромосомы в хромосому, выстраивая дезорганизованные, но «пригодные к эксплуатации» теломеры.
Про словам доктора О'Салливана, этот технически сложный эксперимент очень информативен. «Обмен теломерной ДНК между хромосомами – золотой стандарт обнаружения альтернативного удлинения теломер, - объясняет он. – Увидев его, мы сразу поняли, что потеря ASF1 является индуктором ALT».
До сих пор ученые, занимающиеся изучением рака, придерживались мнения, что обмен теломерной ДНК при ALT может объясняться мутациями в генах, ограничивающих процесс рекомбинации. (Возвращаясь к метафоре с пинг-понгом, эти мутации заставили бы клетки потерять контроль над ракеткой.) Но профессор Карлзейдер уверен, что результаты их исследования просто не оставляют места для дискуссий – молекулярный исходный пункт альтернативного удлинения теломер больше не является предметом споров.
«Наша работа показывает, что подавление ASF1 вызывает альтернативное удлинение теломер за счет нарушения сборки нуклеосом», - говорит он. «Таким образом, наблюдаемая нами рекомбинация в ALT-зависимых клетках является следствием, а не причиной».
Доктор О'Салливан пришел в лабораторию профессора Карлзейдера семь лет назад, чтобы выяснить, изменяют ли ДНК-гистоновые взаимодействия в нуклеосомах функции теломер. Скоро он начнет работу в Онкологическом центре Хиллмана Питтсбургского университета, удовлетворенный тем, что ему удалось показать, что аберрантная хромосомная структура лежит в основе роста значительной части раковых опухолей человека.
«Эта работа иллюстрирует базовую концепцию, - комментирует ученый, - а именно, нарушение порядка в том, как клетки упаковывают ДНК в нуклеосомы, причиняет вред».
Разработка ингибиторов ALT находится на самой ранней стадии, и это исследование поможет фармакологам в создании и оценке эффективности противораковых веществ, мишенью которых будет путь ALT/ASF1.
«Теперь, когда у нас есть контролируемый способ активировать этот путь, мы можем протестировать любой ген, потенциально способный быть ингибитором», - заключает профессор Карлзейдер.
Источник: LifeSciencesToday

