Живая клетка напоминает огромный порт, в котором тысячи единиц груза одновременно прибывают и распределяются в другие порты и на склады. Этот груз транспортируется с помощью микроскопических мембранных пузырьков — везикул. В 2013 году Нобелевскую премию по физиологии и медицине вручили Джеймсу Ротману, Рэнди Шекману и Томасу Зюдофу — «за открытие системы везикулярного транспорта — основной транспортной системы в наших клетках».
Транспортировка молекул внутри мембранных пузырьков (везикул) — основная разновидность внутри- и внеклеточного транспорта у эукариот.
Эукариотические клетки отличаются от прокариот более сложной внутриклеточной организацией, характерной наличием не только клеточного ядра, но и большого количества мембранных органелл — «пузырьков», стенки которых состоят из липидной бислойной мембраны. Собственно, и само ядро можно представить большим пузырьком, играющим роль генетического центра в клетке. В более общем виде это носит название принципа компартментализации: когда внутренность клетки представляет собой не единый мешок (как у бактерий), а совокупность отсеков, в каждом из которых выполняется своя работа, направленная на всеобщее благо.
Разбиение клетки на компартменты сильно повышает эффективность клеточных процессов и не дает многим опасным молекулам «плавать» на свободе. Но это создает и проблему коммуникации: очевидно, что компартменты внутри клеток (как и клетки между собой) должны обмениваться веществом — сигнальными молекулами, «строительным материалом», «импортом» и «экспортом» (см. рис. 1).
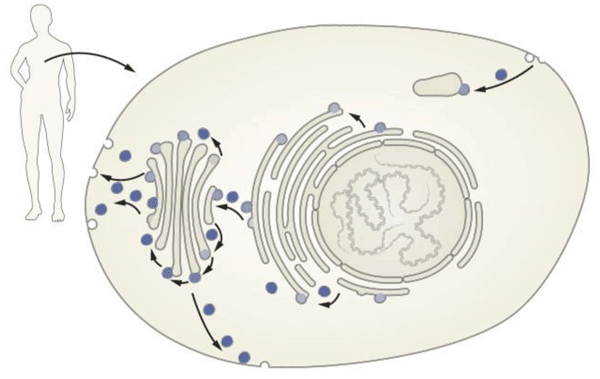
Рисунок 1. Везикулярный транспорт. Каждая клетка нашего организма сложно устроена, и масса важных функций выполняется внутри специальных органелл, «одетых» общей клеточной мембраной. Молекулы, производимые в клетке, «упаковываются» в специальные мембранные пузырьки (везикулы) и доставляются точно вовремя и точно по адресу — будь то та же самая или другая клетка.
Мистика клеточной компартментализации волновала ученых с давних пор (и волнует до нынешнего времени). Совершенствование световой микроскопии легко и наглядно показало отличие эукариотической клетки от бактерий, однако с развитием электронной микроскопии и технологий подготовки биологических образцов внутренний мир клетки буквально ошеломил ученых своим ювелирным устройством. Пионерами этого удивительного мира стали лауреаты Нобелевской премии по физиологии и медицине 1974 года Альбер Клод, Джордж Паладе и Кристиан Де Дюв, подробно исследовавшие внутреннее устройство клетки. Еще раньше Камилло Гольджи открыл названный его именем аппарат Гольджи, служащий «шлюзом» для секретируемых клеткой белков (за это открытие он также был удостоен в 1906 году Нобелевской премии по физиологии и медицине). Наконец, в 1999-м году Нобелевская премия была вручена Гюнтеру Блобелю, открывшему сигнальные последовательности в белках, играющие роль «бирок с адресом».
Однако все это оставляло еще один вопрос не отвеченным: как многие молекулы, включая гормоны, транспортные белки и нейротрансмиттеры, столь точно и своевременно доставляются по адресу? Первый луч света на это был пролит работами Паладе, который показал, что такие молекулы упаковываются в пузырьки, «отпочковывающиеся» от эндоплазматического ретикулума (ЭР) и сливающиеся позже с другими мембранами. Но как именно это происходит, и что управляет этим таинственным процессом, оставалось покрытым мраком.
Гены везикулярного транспорта: при чем тут дрожжи?
Рэнди Шекман (Randy W. Schekman), изучавший биохимию под началом Артура Корнберга (лауреата Нобелевской премии в 1959 году), решил заняться механизмом молекулярного транспорта с позиций генетики и выбрал в качестве модельного объекта пекарские дрожжи (Saccharomyces cerevisiae). Шекман собрался выявить гены, которые участвуют в процессе везикулярного транспорта, с помощью мутантных форм дрожжей и анализа накапливающихся внутри клетки секреторных ферментов.
Первые два открытых гена получили названия sec1 и sec2, а более детальное сканирование выявило в сумме 23 гена. Эти белки разделились на три группы, в зависимости от того, блокировался ли везикулярный транспорт на уровне ЭР, аппарата Гольджи или секреции за пределы клеточной мембраны (см. рис. 2). Позже была определена последовательность событий посттрансляционной модификации, которые управляют процессом секреции. Детальное генетическое и морфологическое исследование «отловило» промежуточные стадии транспорта между ЭР и аппаратом Гольджи, и особенно это было заметно на мутантах sec17 и sec18, в которых секреторные пузырьки накапливались в клетке в большом количестве.
Работы Шекмана заложили генетический базис и выявили ключевые регуляторные события в везикулярном транспорте.
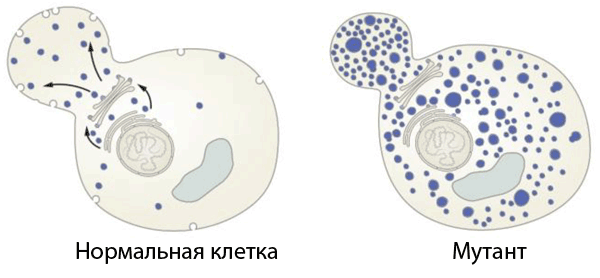
Рисунок 2. Исследование генов везикулярного транспорта. Шекман открыл гены белков, являющихся ключевыми регуляторами везикулярного транспорта. Сравнивая «нормальные» клетки дрожжей с генно-инженерными мутантами с нарушениями транспорта, он выявил гены, отвечающие за транспорт в различные компартменты и на поверхность клетки.
Ключевые белки везикулярного транспорта
Встречным курсом двигался Джеймс Ротман (James E. Rothman), решивший в своей стэнфордской лаборатории выявить ключевые белки (а не гены, как Шекман), работающие в системе везикулярного транспорта. Используя разработанную для этого систему, он выявил ключевые белки, вовлеченные в везикулярный транспорт. На тот момент еще не было системы эффективной экспрессии генов в клетках животных, и использовался подход на основе заражения клеток вирусом везикулярного стоматита (VSV), вследствие чего клетка начинала производить большие количества вирусного белка VSV-G. При этом данный белок специальным образом гликозилируется при достижении аппарата Гольджи, что позволяет точно отслеживать момент доставки «по адресу». Ротман опубликовал несколько работ о везикулярном транспорте VSV-G в системе аппарата Гольджи и выделил из цитоплазмы ключевые компоненты, отвечающие за этот транспорт; одним из таких белков стал N-этилмалеимид-чувствительный фактор (NSF).
Следующим стало открытие фактора SNAP (soluble NSF-attachment protein), связывающегося с мембраной при участии NSF. Знаковым событием, соединившим работы Шекмана и Ротмана, стало понимание того, что ген sec18 кодировал как раз NSF, а sec17 — SNAP (потом было найдено соответствие и остальных генов прочим открытым Ротманом белкам). Это открытие показало, что система везикулярного транспорта является эволюционно древней для эукариот.
Позже был открыт комплекс SNARE (SNAP Receptor), три из компонентов которого — VAMP/синаптобревин, SNAP-25 и синтаксин — работают в составе единого пресинаптического комплекса и отвечают за процесс слияния мембран везикулы и синапса. При этом синаптобревин находится на везикуле, а две другие молекулы — на плазматической мембране. Именно наличие такого «распределенного» комплекса определяет последовательность событий, приводящих к направленному слиянию везикулы с мембраной и, следовательно, регулирует терминальный этап передачи сигнала в возбудимых тканях. В экспериментах in vitro было показано, что SNARE действительно вызывает слияние мембран, причем в весьма специфическом режиме (см. рис. 3).
Ротман разобрался в работе везикулярного транспорта и слиянии мембран, а также в биохимических экспериментах показал, каким образом реализуется специфичность этих процессов.
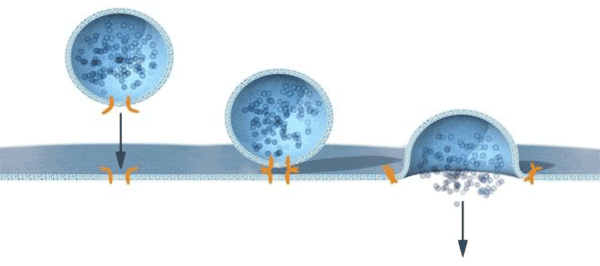
Рисунок 3. Специфичность слияния мембран в везикулярном транспорте. Ротман открыл белковый комплекс, отвечающий за слияние мембраны везикулы с целевой мембраной. При этом везикула несет белки, специфически распознающиеся рецептором «ответной части» (комплекс SNARE), что обеспечивает доставку везикулы по нужному «адресу».
Временнóй контроль слияния везикул
Томас Зюдоф (Thomas C. Südhof) исходно работал в Германии, а потом переехал в США. В организованной им научной группе решали задачу регуляции слияния мембранных везикул, поскольку было понятно, что это событие должно запускаться каким-то внешним сигналом, а вот каким — никто не знал. Эта задача была подсказана процессами выброса медиаторов в синапсах или секреции инсулина в поджелудочной железе, где требуется очень точный временнóй контроль.
Зюдоф заметил, что выброс медиаторов управляется внутриклеточной концентрацией ионов кальция (Ca2+) вблизи пресинаптической мембраны. В итоге он открыл, что комплексин и синаптотагмин являются критически важными компонентами кальций-зависимого слияния мембран (рис. 4).
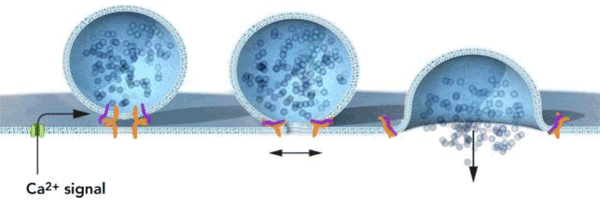
Рисунок 4. Ca2+-зависимое слияние мембран. Зюдоф исследовал, как сигналы передаются от одной нервной клетки к другой, и как ионы кальция регулируют этот процесс. Он открыл молекулярный механизм, «чувствующий» концентрацию кальция и превращающий этот сигнал в событие слияния везикулы с синаптической мембраной, объясняя временнóй контроль формирования и слияния везикул.
В генетических и биохимических экспериментах было показано, что у мышей, «нокаутных» по гену комплексина, нарушен выброс медиаторов из-за падения кальциевой чувствительности синаптической мембраны, — следовательно, этот белок является регулятором слияния. Кроме того, Зюдоф открыл белок синаптотагмин-1, являющийся сенсором кальция и взаимодействующий с фосфолипидами мембран и белками SNARE в ответ на кальциевую стимуляцию.
Зюдоф внес решающий вклад в нейробиологию и клеточную биологию, показав, каким образом осуществляется временной контроль выброса медиаторов в синапсах, а также установив роль ионов кальция в этом процессе.
Везикулярный транспорт и медицина
Работы Ротмана, Шекмана и Зюдофа приподняли завесу тайны над клеточным транспортом в клетке и показали, каким образом молекулы своевременно доставляются в нужное место. Несложно догадаться, что нарушения везикулярного транспорта, учитывая его роль в жизни клетки, приводят к серьезным болезням как нервной, так и эндокринной систем.
Например, такие метаболические расстройства как диабет второго типа характеризуются нарушениями как в секреции инсулина, так и в инсулинзависимом транспорте глюкозы в мышечной и жировой тканях. Кроме того, клетки иммунитета используют везикулярный транспорт для секреции цитокинов и прочих иммунологических молекул, управляющих врожденным и приобретенным иммунитетом.
В некоторых случаях эпилепсии выявляются мутантные формы белка MUNC-18-1, открытого Зюдофом и являющегося продуктом гена sec-1, описанного Шекманом. Мутации в генах MUNC-13-4, MUNC-18-2 и синтаксина-11, также входящих в систему везикулярного транспорта, могут вызывать семейный гематофагоцитарный синдром. При этом заболевании Т-киллеры, работающие не как положено, при встрече со своей «жертвой» инициируют реакцию гипервоспаления, иногда приводящего к смерти. На систему везикулярного транспорта могут действовать и различные токсины: например, ботулотоксин, вырабатываемый бактерией Clostriduim botulinum, расщепляет некоторые компоненты синаптического комплекса, что приводит к блокированию выброса медиаторов, параличу и смерти.
Учитывая вышесказанное, открытия Ротмана, Шекмана и Зюдофа могут пролить свет на механизмы этих заболеваний и дать ключ к их лечению.
Источник: БИОМОЛЕКУЛА

